Inscription / Connexion Nouveau Sujet
Mesure de l'acidité totale et oxydoreduction
Bonsoir.
Je n'arrive pas a répondre aux questions de la partie 1 d'un DM tandis que pour la partie 2 j'ai essayé de répondre aux questions mais je ne suis pas sur de mes réponses. Pourriez vous m'aider? Merci.
PARTIE 1:
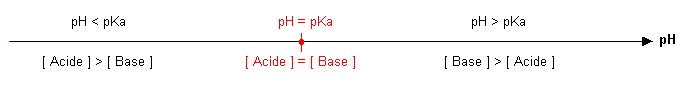
1) On symbolise par la notation AH/A- un couple acide-base. A partir de la définition de la constante d'acidité Ka, établir le domaine de pH où la forme acide du couple est en concentration supérieur à la forme basique dans la solution. En déduire un diagramme de prédominance.
2) Dégazage du vin à l'aide d'une trompe à eau: dessiner et légender le schéma du montage utilisé. Quel est le principe de cette méthode?
3) Un diacide AH2 peut libérer successivement deux fois H3O+. Ecrire les 2 equilibres acide-base correspondant et exprimer les constantes d'acidités Ka1 et Ka2 mises en jeu. En deduire un diagramme de predominance des 3 especes mises en jeu.
4) Le dioxyde de carbone et le dioxyde de soufre presents dans le vin se comportent en solution aqueuse comme des diacides. Ecrire les equilibres acido basiques correspondants en precisant quelles sont les especes acides et les especes basiques.
PARTIE 2:
1)Déterminer le nombre d oxydation de l'azote dans HN03, NH2OH
mes responses: pour HNO3: n.o(N)+n.o(H)+3n.o(O)=0
n.o(N)+n.o(I)+3n.o(-II)=0
n.o(N)=n.o(-I)+3 n.o(II) soit n.o(N)= +V
pour NH2OH: n.o(N)+ 3n.o(H)+n.o(O)=0
n.o(N)=3n.o(-I)+n.o(II) soit n.o(N)= -I
2) Determiner le nbre d oxydation de l iode dans I2 et I04- et I-
Pour I2: 2n.o(i)=0 soit n.o(i)=0
POur I-: n.o(i)=-1
pour Io4-: n.o(i)+4n.o(O)=-1
n.o(i)+4 n.o(-II)=-1
n.o(i)=-1+ 4n.o(II) soit n.o(i)= VII
3) Equilibrer les reactions d'oxydoreduction suivantes:
a)Cr2+ = Cr2O3 (milieu acide)
b)ClO3- + Fe2+ = Cl- + Fe3+ (milieu acide)
Mes reponses : a) 2Cr+ + 2H20= Cr203 +6H+ + 2e-
b) Cl03- + 6H+ + 6Fe2+ = 6Fe3+ + Cl- + 3H20
Est ce juste ?
Merci pour votre aide.
salut  !
!
On va d'abord traiter la partie 1
Question 1) Commence par écrire le couple mis en jeu. Ensuite tu écris le Ka puis tu traces une échelle. Et avec ça tu t'occupes par la suite des domaines de prédominance. Ok ?
2) regarde la partie 2 sur ce lien : ![]()
3) tu vas d'abord avoir le couple AH2/AH puis AH/A-. A toi
4) trouve d'abord les couples
question 1)
AH = H+ + A-
Ka= (A-)/(AH)
est ce juste?
P.s: Je ne comprends pas comment on trace l'échelle et comment on s'occcupe du domaine de predominance.
question2) Le principe de degazage consiste à eliminer le dioxyde de carbone et de soufre afin de determiner l'acidite totale du vin?
P.s: Auriez vous un lien montrant le schema d'un degazage a l'aide d'une trompe à eau ?
question 3) AH2 + H20 = AH + H30+ et AH= A- + H+
est ce juste pour l'instant?
1) tu as déjà vu les échelles de prédominance ?
2) tu dois t'inspirer du lien, simplement dessiner ce qui est écrit
3) oui
1) Si AH = H+ + A-
Ka= (A-)/(AH)
L'échelle de prédominance est l'échelle ci joint en image ?
2) Je comprends toujours pas comment faire mon schéma
3) Laquelle est juste AH2 + H20 = AH + H30+ ou AH2= AH- + H+
4) ?
1) oui c'est bien 
2) tu fais juste un récipient contenant du vin, sur lequel est "branché" une pompe à eau
3) les deux sont bonnes à vrai dire
3) Ka1= (AH)(H3o+)/(AH2)
Ka2=(A-)/(AH)
4) Et pour cette question "Le dioxyde de carbone et le dioxyde de soufre presents dans le vin se comportent en solution aqueuse comme des diacides. Ecrire les equilibres acido basiques correspondants en precisant quelles sont les especes acides et les especes basiques. "
Que dois je faire ?
2) utilise un chauffage à reflux avec chauffe-ballon, colonne de Vigreux, ballon, etc.
4) quels couples acido-basiques faisant intervenir ces deux espèces connais-tu ?
Pense à HSO3 et HCO3 par exemple 
Donc pour la question 4 je dois marquer:
CO2+ H20 = HC03
SO2 + H20 = HS03
ESt ce juste?
Mais ici lesquels sont les bases et lesquels les acides ?
CO2 + H20 = HCO3- + H+ avec CO2,H20 qui sont des acides et HC03- une base
SO2 + H20 = HSO3- + H+ avec SO2, H20 qui sont des acides et HSO3- une base ?