Inscription / Connexion Nouveau Sujet
Impureté du cristal parfait
Bonjour à tous,
Voilà, je réalise actuellement une analyse documentaire qui porte sur les défauts du cristal réel (notamment de Schottky et Frenkel). Je dispose d'un corpus de document joint de question. J'ai réussi les première questions qui porte sur la représentation de mailles, calculs divers etc..
Mais, je bloques sur les deux dernières question qui porte sur le document ci-dessous recopié :
Les défauts de Schottky et Frenkel ne changent pas la composition globale du solide : ils sont dits "stoechiométrique".
Il existe d'autres défauts qui, eux, modifient la formule du solide. Prenons l'exemple de l'oxyde de fer(II) FeO, dont le cristal parfait cristallise dans une structure de type NaCl (les ions O2- constituent un réseau cfc et les ions Fe2+ occupent la totalité des sites octaédriques).
Des études montrent que le cristal réel à une formule du type Fe(1-x)O. Le défaut de fer apparait sous formes de lacunes cationiques (certaines positions correspondant à Fe2+ sont vides).Pour compenser le manque de charges positives lié à ces lacunes, il a présence d'ions Fe3+ (deux ions Fe3+ par lacunes cationique) issus de l'oxydation d'ions Fe2+ par le dioxygène de l'air, ce qui peut être traduit par un bilan comparable à celui d'une réaction chimique :
2Fe2+ + 1/2 O2(g) = 2 Fe3+ + O2- + lacune en fer
On peut associer à cette équation une constante d'équilibre faisant intervenir les activités de chacun des différents participants :
- les ions Fe2+ et O2- étant très majoritaires, leur activité est égale à 1 (comparable à un solvant)
- les lacunes et les ions Fe3+ sont très minoritaires : leurs activités se calculent comme celle d'un soluté (à partir de leurs concentrations)
La conductivité électrique du cristal n'est pas interprétée par le mouvement réel d'un ion dans la structure, mais par l'échange électronique qui peut exister entre un ion Fe2+ (qui joue le rôle d'un réducteur et cède un électron) et un ion Fe3+ (qui joue le rôle d'un oxydant et capte un électron). La conductivité sigma et alors proportionnelle à la concentration en ions Fe3+ dans le cristal.
1) En admettant que la population de la maille n'est pas affectée par cette non stoechiométrie (la formule de l'oxyde de fer s'écrivant , calculer la valeur de x.
2) Proposer un schéma illustrant la conductivité de l'oxyde de fer
3) Montrer que cette courbe (pièce jointe) est cohérente avec le modèle de conductivité proposé dans le document.
Merci d'avance !
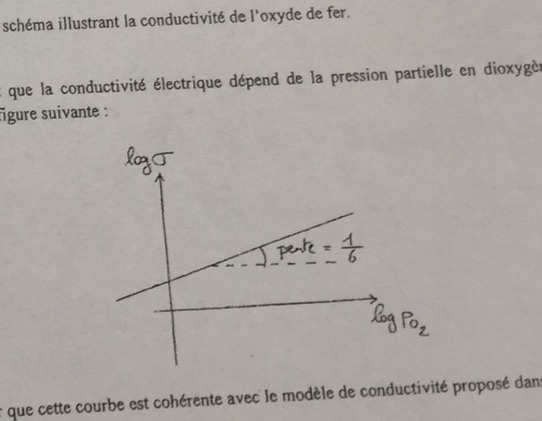
J'ai écrit les 2 demi équations redox pour la question 3, et j'ai utiliser Nernest et l'égalité des potentiel à l'équilibre chimique mais je trouve une pente de 1/4 au lieu de 1/6..
( je n'ai pas intégré les lacunes dans mes calculs)
Bonjour
Je n'ai pas utilisé la notion de potentiel de Nernst . Je me suis juste contenté d'écrire que l'équilibre thermodynamique est atteint. J'appelle a l'activité de chaque constituant et K la constante thermodynamique d'équilibre :
Soit en tenant compte des indications de l'énoncé et en notant P° la pression standard de 1bar : et :
En écrivant que la conductivité est proportionnelle à la concentration en ions fer(III), donc à l'activité de cet ion, j'obtiens comme toi une pente de ... Erreur d'énoncé où quelque chose nous a échappé ???
où quelque chose nous a échappé ???
J'ai trouvé mon erreur : dans l'expression du quotient de réaction, il faut considérer la lacune créée comme une entité chimique à part entière :
Il y a deux fois moins de lacune que d'ions fer(III) :
Cela conduit bien à une pente de
Oui, je n'ai pas non plus tenu compte des lacunes, merci !
Sinon, pour la 1) j'ai utilisé la notion de masse volumique :
J'ai oublié de préciser qu'on nous indiquait que la masse réelle d'un cristal d'oxyde de fer réel était de 5700kg.m-3
Du coup je résous :
On nous donne : M(Fe)=55,85g.mol-1 M(O)=16,00g.mol-1
rayon ioniques : Fe2+ = 76pm et O2-=140pm
D'ou :
Et j'obtient y=2,67 donc tout se passerait "comme si" la masse volumique du fer était de 53.18g soit x=0,05 (pourcentage de la valeur en moins)
Validez vous ?
Pour la conductivité j'ai représenté les trois molécules constituant le cristal et j'ai rajouté des lacunes qui permettent les mouvement des ions
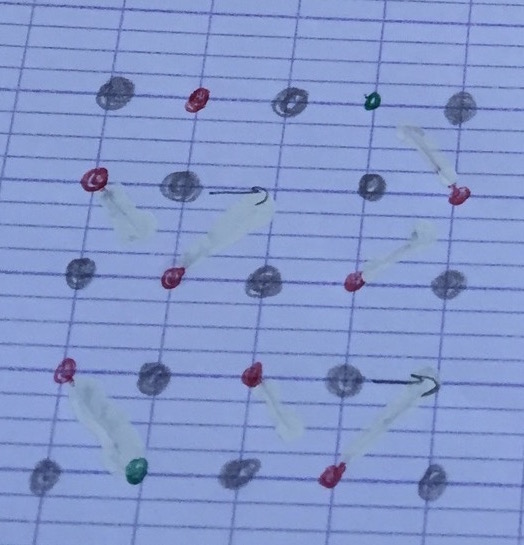
Validez vous ?
Globalement d'accord. J'imagine que tu es capable de justifier la valeur de a et la valeur de n que tu as utilisées.
Juste un détail : il ne me semble pas indispensable (je ne dis pas "faux") d'introduire l'inconnue y. Il suffit d'écrire directement la masse molaire sous la forme :
M = (55,85(1-x)+16)10-3kg/mol.
On obtient ainsi directement : M=69,18g/mol et x = 4,77%


