Inscription / Connexion Nouveau Sujet
gaz parfait
Bonjour,
ayant des difficultés en physique j'aimerai avoir un peu d'aide.
Un gaz parfait occupe un volume de 5L avec une température à 300K et une pression de 105Pa.
Ce gaz subit une détente isobare et arrive à un volume de 10L.
-Au cours de cette détente est-ce que la vitesse quadratique moyenne des molécules de ce gaz double ?
J'aurai répondu oui mais d'après la correction c'est faux car la vitesse quadratique des molécules est racine de 3RT/M donc il faut multiplier par 2.
Je ne comprends pas pourquoi.
Merci de m'aider.
Bonsoir,
La loi des gaz parfaits indique que, à quantité constante et à pression constante, le quotient V/T reste constant . Multiplier le volume par 2 conduit à multiplier T par 2.
Le cours de thermo statistique montre que l'énergie interne du gaz parfait, égale à l'énergie cinétique moyenne des molécules de gaz, est proportionnelle à T . C'est donc le carré de la vitesse quadratique moyenne qui est proportionnelle à T et non la vitesse quadratique moyenne.
Donc multiplier T par 2, revient à multiplier la vitesse quadratique moyenne par  2 !
2 !
Bonjour Vanoise 
Merci pour ta réponse!
J'ai bien compris pour V/T reste constant lorsqu'on multiplier le volume par 2 conduit à multiplier T par 2.
Par contre j'aimerai bien savoir si c'est à cause de la présence du carré qui fait que le carré de la vitesse quadratique moyenne soit proportionnelle à T. S'il n'y avait pas la présence du carré, la vitesse moyenne quadratique serait proportionnel à T du coup on aurait pu multiplier par 2? Mais vu que ce n'est pas le cas on multiplie par racine de 2?
Tu as raison ! C'est bien à cause du carré !
Je note u la vitesse quadratique moyenne. u2 est proportionnel à T : on peut donc écrire :
u2=a.T où a est une constante positive.
Cela conduit bien à :
u= a .
a . T.
T.
 a est une constante : u est bien proportionnelle à
a est une constante : u est bien proportionnelle à  T mais cela était déjà contenu dans la formule de ton cours valide pour les gaz parfait monoatomique :
T mais cela était déjà contenu dans la formule de ton cours valide pour les gaz parfait monoatomique :
C'est beaucoup plus claire! 
Je te remercie beaucoup pour ton aide et tes super explications Vanoise! 
Il n'y a pas de gaz parfait, tous les gaz peuvent être assimilés à des gaz parfaits pourvu que leur pression soit très faible et leur température loin de la température de condensation. La notion de gaz parfait permet de faciliter les calculs thermodynamiques.
Je ne comprends pas ce qu'est une détente isobare, un gaz se détend quand sa pression baisse et il décrit un isobare quand sa pression demeure constante, il y a contradiction dans l'énoncé du problème. Pour le reste les explication de Vanoise sont très claires.
Totalement d'accord avec le message de JoseManuel, tant sur la notion de gaz parfait que sur celle de détente. Le mot détente est réservé aux évolutions avec diminution de pression, par opposition au mot compression qui correspond lui à une augmentation de pression. L'expression "dilatation isobare" me semble plus correcte dans ce contexte.
Bonsoir! 
Merci pour vos nombreux réponses et explications!
Dans mon cours tous les gaz peuvent être assimilés à des gaz parfaits (comme l'a dit JoseManuel) si on considère certains propriétés qui permettent de les considérer comme tel pour résoudre un problème.
Sinon pour l'énoncé, c'était bien "détente isobare" bien que ce soit moins correcte en effet :/
La question "peux-tu m'en citer un" était évidemment destiné à namizo ... pour voir s'il avait bien compris les différences entre un gaz réel et le "modèle thermodynamique" de gaz parfait.
On ne saura maintenant jamais si c'était le cas... Tant pis.
En thermodynamique, le mot détente n'est pas réservé à une transformation avec diminution de pression (même si c'est ainsi qu'on l'utilise le plus fréquemment).
On peut aussi envisager la "détente volumique" ... qui peut très bien se faire à pression constante... et est alors une "détente volumique isobare" qui est raccourcie en "détente isobare"
La notion de "taux de détente volumique" est le plus souvent utilisé dans le domaine des turbines ou des moteurs thermiques.

Bonjour,
Intéressante mais intrigante, la remarque de J-P sur les détentes... Je viens de consulter plusieurs dictionnaires et encyclopédies (pas seulement Wikipédia...) : tous mes documents sont d'accord sur le point suivant :
"détente d'un gaz : diminution de la pression d'un gaz." Alors : si les physiciens, a fortiori ceux qui veulent aider les étudiants, ne parlent pas français : où allons- nous ?
Effectivement, dans le domaine des turbines et des moteurs, on peut définir un taux de détente volumique dans la mesure où la variation de pression s'accompagne aussi d'une variation de volume. Mais une turbine traversée par un gaz avec pression de sortie égale à pression d'entrée ???
Si J-P pouvait expliquer cela...
D'avance merci !
Bonjour,
Que J-P ne se méprenne pas sur le sens de ma phrase sur l'emploi de la langue française : elle concerne les quelques professeurs qui posent ce genre d'exercice : je pense vraiment qu'écrire "détente isobare" dans un exercice ou problème peut perturber des étudiants débutants en thermodynamique.
Et bien, vanoise je ne suis pas d'accord avec toi.
On trouve de multiples définitions ... et les plus habituelles ne sont pas forcément les meilleures.
Je lis par exemple dans Wiki :
Détente (thermodynamique)
La détente est le contraire de la compression. Un gaz augmente son volume en se chauffant et / ou en baissant sa pression.
Même si on peut ergoter, la détente est ici définie par une augmentation de volume ... qui peut être (entre autre) être la conséquence de la température (en se chauffant).
Et ceci peut se faire évidemment à pression constante, ce qui serait alors une détente isobare.
Peu importe que beaucoup pensent : détente = diminution de pression.
La définition est pour d'autres : détente = augmentation de volume
Le fait que "détente isobare" soit le plus souvent utilisé dans des pans particuliers de thermodynamique ne change rien.
Même si cela choque certaines habitudes, on ne peut pas ignorer le vocabulaire (ou jargon) habituel à certains domaines.
Je ne suis ni pour ni contre le vocable "détente isobare", ce vocabulaire est fréquemment utilisé (ailleurs peut-être que dans l'enseignement qui ne regarde pas assez ce qui se passe dans le monde du travail (çà c'est mon avis)).
Certains ont peur de ce vocable et remplace "détente isobare" par "transformation isobare" ... perdant ainsi une information sur le sens de la "transformation".
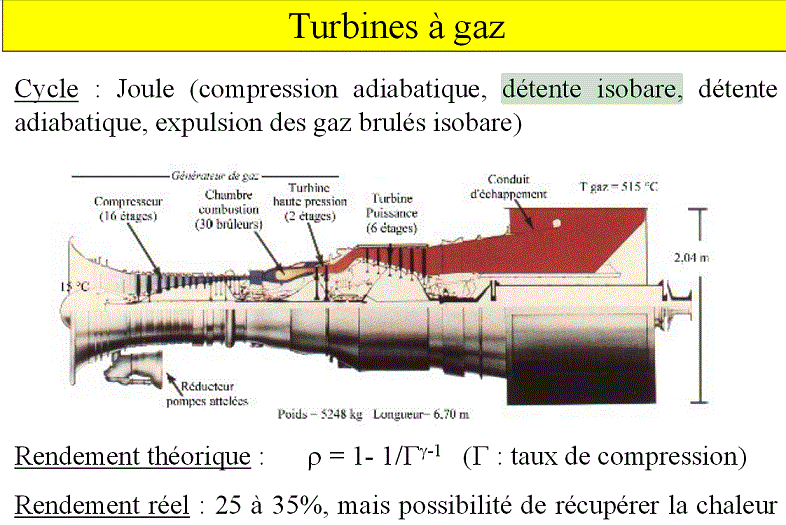
Beaucoup quand même (heureusement puisque c'est conforme à ce qu'on fait dans certains métiers) de cours ou exercices utilisent "détente isobare" (par exemple ici : ![]() , comme ils sont en concordance avec ce qui se fait dans des domaines comme les turbines ou moteur thermiques ou ..., pour moi ils ont raison.
, comme ils sont en concordance avec ce qui se fait dans des domaines comme les turbines ou moteur thermiques ou ..., pour moi ils ont raison.
Il faut se méfier des définitions des dictionnaires de langage commun (non péjoratif) comme Le Larousse ou le Petit Robert, elles sont souvent tronquées et ceci est vrai pour toutes les Sciences (même en Math, ou les définitions des dictionnaires mathématiques s'éloignent souvent de celles des autres dictionnaires)
Quoiqu'il en soit, même si cela va à l'encontre de ce que la majorité pense, comme le vocable "détente isobare" est bel et bien utilisé (et même par des spécialistes dans certains métiers), il ne sert à rien de le repousser d'un revers de main en prétendant que cela ne veut rien dire ou "soit disant" contradictoire.
Le mieux est, pour moi, d'utiliser la définition qui est celle de ceux qui l'utilisent.

Bonjour J-P,
Pour la question de vocabulaire, je pense effectivement que les étudiants débutants dans un discipline ont besoin de repères de langage et de définitions claires et simples. Pour moi le mot "détente" implique une diminution de pression, contrairement au mot "dilatation". Quant aux spécialistes d'un sujet donné dans le monde de travail, qu'ils utilisent entre eux des définitions spécifiques, souvent mêmes des unités spécifiques, cela est effectivement courant : l'essentiel est qu'ils se comprennent entre eux ; cela ne veut pas dire que ces conventions de langages spécifiques doivent être enseignées à des étudiants débutants.
Mais l'essentiel n'est pas là : les messages précédents laissent clairement entendre qu'il est possible, dans une turbine ou un moteur, d'avoir une détente volumique isobare. Je reprends donc la fin de mon message précédent :
Effectivement, dans le domaine des turbines et des moteurs, on peut définir un taux de détente volumique dans la mesure où la variation de pression s'accompagne aussi d'une variation de volume. Mais une turbine traversée par un gaz avec pression de sortie égale à pression d'entrée ???
Si J-P pouvait expliquer cela...
D'avance merci !
Ce terme de "détente isobare" dans le schéma que tu as indiqué me semble bizarre J-P. Je suis d'accord que le passage dans la chambre de combustion est représentée dans le cas idéale par une isobare mais dans mes cours de moteurs/propulseurs on parlait toujours simplement de "chauffage" en précisant dans les hypothèses que ce chauffage pouvait être considéré comme isobare (même si dans la réalité il ne l'est pas réellement ce qui fait que l'on génère plus d'entropie pour arriver à la même pression et ce qui fait diminuer le rendement par rapport au cycle idéal).
Totalement d'accord avec Florian. D'ailleurs, sur la dizaine de sites que je viens de consulter au hasard sur la turbine à gaz, je n'en ai trouvé qu'un utilisant le terme de détente isobare. Mais je n'ai toujours pas de réponse à ma question posée à J-P !
Le dispositif décrit au-dessus est formé d'un compresseur, d'une chambre de combustion, de deux turbines et d'un échappement ; c'est vrai que, par abus de langage, on appelle souvent l'ensemble "turbine à gaz" même si l'expression "turbine à combustion" semble plus appropriée. Lorsqu'on parle habituellement de turbine sans autre précision, on parle exclusivement de la partie motrice du dispositif précédent, analogue, à un facteur d'échelle près, à celles que l'on peut trouver dans une centrale électrique pour entraîner l'alternateur. J'aimerais que J-P m'explique comment une telle turbine peut fournir de la puissance si la pression d'entrée est égale à la pression de sortie, bref, si le gaz y subit une "détente volumique isobare" comme il l'a écrit plus haut !
Nouveau sur ce site, j'aimerais aussi une réponse sur la nécessité ou non d'utiliser à destination des étudiants souvent débutants qui fréquentent le site pour trouver de l'aide, un vocabulaire rigoureux et "standardisé" ou s'il faut au contraire, pour mieux les initier à leurs futures vies professionnelles, leur enseigner les "raccourcis et approximations de langage" propres au mécanicien, à l'informaticien, à l'opticien, au thermodynamicien...
Bonjour vanoise 
Je tiens juste à préciser quelque chose (je ne t'ai peut-être pas complètement compris) mais dans un moteur d'avion en tout cas (donc une variation de la turbine à gaz mais même principe de fonctionnement), on suppose normalement que la pression dans le plan de sortie est égale à la pression à l'aspiration. Ce qui génère principalement de la poussée est le fait que l'air en sortie de moteur possède une vitesse plus grande qu'en entrée (voir ici pour des informations complémentaires : ![]() )
)
Par contre si je ne me trompe pas on a variation de la pression totale lors du cycle que subit l'air à l'intérieur du moteur (et variation de la température totale également, mais ceci n'est pas le sujet).
Je suis par contre d'accord de dire que la pression entre par exemple deux étages de compression ne peut pas être égale, sinon l'étage de compression (ou de détente après la chambre de combustion) est inutile.
Florian
Bonjour,
Voici quelques données chiffrées concernant le fonctionnement d'une turbine de centrale électrique utilisant la vapeur d'eau comme gaz. La vapeur d'eau entre dans la turbine dans un état (1) caractérisée par :
une température t1 = 600°C ; un volume massique v1 = 38,4.10-3m3/kg.
Elle ressort de la turbine dans un état (2) caractérisé par :
une température t2 = 13,0°C ; un volume massique v2 = 88,0m3/kg.
On peut effectivement définir un taux de détente volumique par le quotient : rv=v2/v1 = 2292.
Cette valeur a une grande importance pratique : en régime permanent, le débit massique est le même à l'entrée et à la sortie mais le débit volumique de sortie est rv fois plus grand que le débit volumique d'entrée ; cela impose de grosses contraintes pratiques au niveau de l'installation .
La pression d'entrée est P1 = 100bars ; la pression de sortie est P2 = 0,15bar. P2 < P1 : il est donc correct de parler de "détente" mais parler de détente volumique isobare alors que P1/P2 = 667...
Remarque : en pratique, on utilise une turbine à plusieurs étages (en fait une succession de plusieurs turbines d'axe de rotation commun) et on réchauffe le gaz entre la sortie d'un étage et l'entrée dans le suivant : cela augmente le rendement énergétique de l'installation et surtout évite la formation d'eau liquide dans la turbine.
Mais la différence avec ce type de turbine ne vient-elle pas du fait que l'on parle ici de cycle fermé alors que dans le cas d'une turbine à gaz on est dans le cas d'un cycle ouvert (même si représenté dans la littérature par un cycle fermé car on "relie" le point dans le plan de sortie au point dans le plan d'entrée) ?
D'après mes cours d'ailleurs on essaie toujours d'être dans le cas adapté (encore une fois, pour les moteurs d'avion) ce qui signifie que la pression dans le plan de sortie est elle aussi égale à la pression atmosphérique.
Cependant je suis tout à fait d'accord pour dire que la pression d'un étage de compression à un autre et d'un étage de détente à un autre n'est pas égale car les étages seraient sinon inutiles.
Je rajouterais d'ailleurs encore une précision, directement à la sortie de la partie "turbine basse pression", l'air n'est en effet pas à la pression atmosphérique. C'est après dans la partie "tuyère" (qui est spécialement construire de façon justement à être adaptée, d'habitude en choisissant comme condition dans le plan de sortie les conditions atmosphériques à l'altitude de croisière) que l'air est détendu davantage afin de l'accélérer et qu'il "sorte" à une pression égale à la pression atmosphérique.
Dans les turbines industrielles s'est légèrement différent, il n'y a pas de tuyère (car l'industriel ne met pas du carburant dans ses turbines pour accélérer de l'air) et on rajoute alors des étages supplémentaires de turbines afin de récupérer l'énergie apportée à l'air par la combustion et c'est ces derniers étages de turbines qui permettent d'entraîner des alternateurs, etc.
Florian
Faute de frappe dans l'application numérique concernant le turbine de la centrale : il faut lire P2 = 0,015bar et P1/P2=6667.
Pour répondre à Florian : d'accord pour dire que la turbine de puissance d'une turbine à combustion (turbine à gaz) appartient à un système ouvert alors que la turbine d'une centrale électrique appartient à un système fermé mais dans les deux cas, il est possible de l'étudier indépendamment du reste du système et donc de la considérer comme un système ouvert. La totalité de mes propos concernant les turbines s'applique exclusivement aux turbines de puissance considérées comme systèmes ouverts. Pour l'étude globale du système, on peut étudier séparément les différentes parties du système et ensuite s'intéresser aux débits massiques les traversant. Cette méthode est plus générale y compris pour les centrales thermiques. Pour ces centrales, le système est certes globalement fermé mais il n'est pas toujours possible de parler de cycle dans la mesure où une petite fraction de vapeur est "soutirée" à la sortie d'un étage intermédiaire de la turbine pour être injectée en aval de la chaudière pour réchauffer le liquide qui rentre dans celle-ci : au prix d'une très faible perte de puissance fournie par la turbine, on réalise une économie importante de puissance thermique dépensée pour chauffer la chaudière, ce qui se traduit par une augmentation du rendement.
Pour le rôle des étages, outre la possibilité de soutirage déjà évoquée, l'intérêt principal, selon moi, réside dans le fait qu'il est possible d'installer des échangeurs thermiques entre les étages successifs. On démontre que, pour un taux de compression donné, la puissance mécanique nécessaire à l'entraînement d'un compresseur est minimale pour une compression isotherme alors que la puissance fournie par une turbine est maximale pour une détente isotherme. Les compressions et détentes idéales sont donc isothermes alors que de telles évolutions isothermes sont impossibles à obtenir pratiquement (du moins avec des débits massiques importants). Malheureusement, les évolutions réelles, modélisables par des polytropiques, sont plus proches de l'adiabatique que de l'isotherme : une compression réelle tend à échauffer le gaz, une détente réelle tend à le refroidir. Donc, pour se rapprocher de l'isotherme, on refroidit le gaz entre deux étages d'un compresseur et on le réchauffe entre deux étages d'une turbine.
Dans le cas des turbines utilisant de la vapeur d'eau en entrée, il y a un second intérêt : le réchauffement entre les étages empêche la liquéfaction partielle de la vapeur : cela apparaît clairement sur un diagramme de Mollier. Or la présence de liquide dans la turbine est gênante, la présence de liquide augmente les frottements donc diminue le rendement et use prématurément les parties mobiles de la turbine.
Tout cela est assez technique ; si mes explications ne sont pas suffisamment claires, je veux bien répondre à des questions supplémentaires.
Très intéressant vanoise, ça me rappelle mes cours de Thermodynamique de l'an dernier, en un peu plus technique tout de même, s'est plaisant à lire 
"on parlait toujours simplement de "chauffage" en précisant dans les hypothèses que ce chauffage pouvait être considéré comme isobare"
Et bien pour d'autres, une augmentation de volume d'un gaz par chauffage à pression constante est appelée "détente isobare".
Il est inutile de polémiquer même si cela en heurte certains, attribuer cela à des raccourcis ou des approximations de langage est puéril.
Est-ce si difficile d'accepter que le vocable utilisé par des "spécialistes" dans un métier est légitime même si il va à l'encontre de certaines de nos "fausses certitudes" ?
Bonsoir J-P,
Je ne polémique pas ; je cherche juste à obtenir des réponses à deux questions que j'ai posées ce jour 4/8 à 14h06.
Je ne vais certainement pas me lancer dans des explications sur le fonctionnement de la turbine que j'ai mis en copie (ce n'est d'ailleurs pas mon domaine de prédilection) parce que tu as du mal à admettre que ce que tu as décrété faux, soit le vocable "détente isobare" est bel et bien un terme employé et pas par n'importe quel quidam qui ne sait pas ce qu'il dit, mais par des pros du métier au minimum dans les domaines des turbines et des moteurs thermiques.
Soit dit en passant, on ne mentionne pas dans le lien que la seule détente isobare, on y mentionne aussi une détente adiabatique, une compression (compresseur) …
Et il y a aussi un apport d'énergie (en chauffant le gaz) qui permet la détente isobare…
On retrouve aussi l'utilisation de « détente isobare » dans de multiples cours ou exercices sur le sujet.
Par exemple (entre pleins d'autres si on prend la peine de chercher) ici :
![]()
Je suppose que tu vas aussi prendre leurs auteurs pour des rigolos ou les classer dans les profs qui n'utilisent pas le vocabulaire adéquat et mettent ainsi de mauvaises interprétations chez les élèves ou étudiants et par là dans le même sac le prof de namizo (et beaucoup d'autres, heureusement).
Que préférer ?
Des profs tenant compte de ce qui se pratique dans le monde "hors enseignement" enseignant à leurs étudiant le vocabulaire employé dans le domaine "industriel"... qu'ils seront susceptibles de rencontrer.
OU
Des profs qui pensent que leurs définitions sont forcément les bonnes à défaut de toutes autres et réfutent ce qui se pratique dans le monde industriel et enseigne leur vue à oeillères à leurs étudiants.
Juste un peu de physique pour changer.
Pour bien fixer le vocabulaire: j'emploie de mot "turbine" pour désigner uniquement le dispositif moteur, celui qui entraîne l'alternateur d'une centrale électrique, celui qui entraîne le compresseur dans l'ensemble {compresseur, chambre de combustion, turbine, conduit d'échappement}, ensemble habituellement appelé "turbine à gaz" ou "turbine à combustion".
Pour calculer l'énergie mécanique fournie par la turbine, pas question d'intégrer une "formule" de type " W=-P.dV" puisque la turbine constitue un système ouvert.
W=-P.dV" puisque la turbine constitue un système ouvert.
Pour un système ouvert traversé par un gaz en régime permanent, l'expression de l'énergie reçue par chaque kilogramme de gaz traversant la turbine, dans le cas limite d'une évolution réversible s'écrit :
.
Le mot "reçu" doit être compris au sens algébrique habituel en thermodynamique. Pour que la turbine puisse fournir de l'énergie à un alternateur ou un compresseur, il faut : w' < 0.
Cela suppose donc obligatoirement une diminution de la pression du gaz au cours de la traversée de la turbine. En aucun cas, l'évolution du gaz dans la turbine ne peut être qualifiée d'isobare.
Bien sûr, dans la réalité, la détente n'est pas réversible et la valeur absolue de la valeur réelle de w' est inférieure à celle que l'on peut calculer par la formule précédente mais cela ne change rien aux signes !
Conclusion : l'évolution d'un gaz dans une "turbine" ne peut en aucun cas être isobare.
En revanche, parler d'évolution isobare dans une turbine à gaz est incomplet mais pas faux dans la mesure où la combustion dans la chambre de combustion est le plus souvent assimilable à une évolution isobare.
Balivernes.
Si tu en es encore à penser qu'il existe une seule définition pour une détente ... et que bien sûr c'est celle que tu utilises, tu te mets le doigt dans l'oeil jusqu'au coude.
Tes élucubrations sont basées sur la définition que tu juges comme la seule de la détente ... Mais c'est archi prétentieux de ta part et aussi archi faux.
D'autres utilisent une autre définition et pour eux, c'est ce que tu racontes qui est faux.
Ceci est malheureusement vrai (la non uniformité des définitions ou de signification d'un mot de vocabulaire) pour une multitude de notions, en Math, en Physique et ailleurs.
Je l'ai déjà dit, je ne prends pas parti pour l'une ou l'autre définition, je m'en fous ... mais j'ai au moins les yeux suffisamment ouverts pour savoir que différentes définitions existent pour une détente...
Et ne m'émeus donc pas d'une "détente isobare" sachant ce quelle signifie pour ceux qui l'utilisent à juste titre conformément à LEUR définition et tant pis pour les autres.