Inscription / Connexion Nouveau Sujet
Équilibrer une équation
Bonjour à tous,
Lors d'un exercice il fallait équilibre une équation. Étant en paces, cet exercice devait être résolu dans un temps de 1min30 et j'ai mis plus de 5 minutes. Là n'est pas la question, j'aimerais comprendre quelque chose :
La réaction était :
KMnO4 + H2O2 + H2SO4 --> K2SO4 + MnSO4 + H20 + O2
J'ai trouvé les coefficients : 2,5,3 --> 1,2,8 et 5.
J'ai mis beaucoup de temps car je ne voyais pas comment l'équilibrer avec la méthode des demi-équations étant donné le nombre de couples ni avec le nombre d'oxydation ne connaissant pas la plupart des nombres d'oxydation (notre professeur nous a fait apprendre que l'oxygène et l'hydrogène). Pourriez-vous m'expliquer comment effectuer ceci rapidement s'il vous plaît?
Merci par avance, bonne journée!
KMnO4 + H2O2 + H2SO4 --> K2SO4 + MnSO4 + H20 + O2
K n'est présent que dans un seul "produit" à gauche et à droite ---> on commence par équilibrer les K
2 KMnO4 + H2O2 + H2SO4 --> K2SO4 + MnSO4 + H20 + O2
Mn n'est présent que dans un seul "produit" à gauche et à droite ---> on équilibre les Mn
2 KMnO4 + H2O2 + H2SO4 --> K2SO4 + 2 MnSO4 + H20 + O2
S n'est présent que dans un seul "produit" à gauche ---> on équilibre les S
2 KMnO4 + H2O2 + 3 H2SO4 --> K2SO4 + 2 MnSO4 + H20 + O2
Reste à équilbrer les H et les O sans modifier les coeff déjà trouvés :
Je choisis des coefficients a, b et c tels que :
2 KMnO4 + a H2O2 + 3 H2SO4 --> K2SO4 + 2 MnSO4 + b H20 + c O2
On obtient le système :
Pour équilibrer les O : 8 + 2a + 12 = 4 + 8 + b + 2c
Pour équilibrer les H : 2a + 6 = 2b
2a + 8 = b + 2c
a + 3 = b
b = a+3
2c = 2a + 8 - a - 3 = a + 5 ; c = (a+5)/2
On arrive à : 2 KMnO4 + a H2O2 + 3 H2SO4 --> K2SO4 + 2 MnSO4 + (a+3) H20 + (a+5)/2 O2
On peut donner à a n'importe qu'elle valeur positive ...
Il y a donc une infinité de manières d'équilibrer cette réaction...
Ta réponse est une des solutions possibles, elle correspond à celle avec a = 5
-----
Mais comme je n'y connais rien en chimie, il vaudrait mieux attendre la réponse d'un vrai chimiste.

Tu as deux couples redox : MnO4 - ( degre 7 pour Mn) /Mn2+ (degré2)
MnO4 - +5e- +8H+ -> Mn2+ + 4H2O
et H2O2 (degré-1 pourO )/O2(degré0) : H2O2 -> O2 +2H+ + 2e-
Tu écris la réaction bilan ( 2*la première +5*la seconde) et tu vas rajouter les K+ et les SO4 2- ... et le tour est joué !
Bonjour,
Je ne voudrais pas polémiquer inutilement, mais, sur un sujet comme l'oxydo-réduction, Man369 devrait suivre les conseils de anniejeanne et oublier le message posté le 09-10-15 à 11:42. Sinon, son professeur va lui rire au nez...
Il me semble que si on mélange du permanganate de potassium avec du H2O2, il se comporte en donneur d'électrons.
H2O2 --> 2 H+ + O2 + 2e-
Les 2 demi réactions devraient être :
MnO4- + 8 H+ + 5e- ---> Mn(2+) + 4 H2O
H2O2 --> 2 H+ + O2 + 2e-
En équilibrant :
2 MnO4- + 16 H+ + 10e- ---> 2 Mn(2+) + 8 H2O
5 H2O2 --> 10 H+ + 5 O2 + 10e-
-->
2 MnO4- + 16 H+ + 10e- + 5 H2O2 ---> 2 Mn(2+) + 8 H2O + 10 H+ + 5 O2 + 10e-
2 MnO4- + 6 H+ + 5 H2O2 ---> 2 Mn(2+) + 8 H2O + 5 O2
Les protons viennent du H2SO4 -->
Et donc : 2 KMnO4 + 5 H2O2 + 3H2SO4 ---> 2 MNSO4 + K2SO4 + 5 O2 + 8 H2O
Et on retombe évidemment sur ce que j'avais annoncé, soit une forme :
2 KMnO4 + a H2O2 + 3 H2SO4 --> K2SO4 + 2 MnSO4 + (a+3) H20 + (a+5)/2 O2
... mais avec la valeur de a qui a été trouvée.
Toujours, sans rien y connaître en chimie.

Effectivement : ce n'est pas parce qu'une réaction est conforme à la conservation des éléments chimiques qu'elle peut avoir réellement lieu. Elle obéit à différentes autres lois suivant le contexte. Et en oxydo-réduction, cette autre loi est la conservation des nombres d'oxydation. Pour la vérifier, tu peux utiliser la méthode des demies équations exposée ci-dessus : c'est à mon avis la plus générale : elle te servira sans doute dans la suite de ton programme si tu dois, par exemple, travailler à partir des potentiels de Nernst. On peut éventuellement équilibrer directement sans passer par les demies réactions : c'est peut-être ce que demande ton professeur ; c'est un peu plus rapide mais moins général que la méthode des demies réactions. Je te l'expose au cas où mais, si tu as bien compris la méthode des demies réactions, laisse tomber.
Tu écris directement l'équation bilan, sans tenir compte des espèces indifférentes dans un premier temps. Tu détermines les nombres d'oxydation comme cela t'a été expliqué par anniejeanne et tu exprimes les variations de nombres d'oxydation notés  NO. Cela correspond à l'image ci-dessous :
NO. Cela correspond à l'image ci-dessous :
puisque chaque élément O de H2O2 voit son NO augmenter de 1 et que chaque élément Mn voit le sien diminuer de 5, pour avoir une somme algébrique nulle des variations de NO, il faut faire intervenir 5 fois plus d'atomes O (appartenant à H202) que d'atomes Mn ; d'où les coefficient 5/2 devant H2O2 et O2.
La suite est évidente et classique :
conservation du nombre total d'atomes O : cela conduit à 4H20 ;
conservation du nombre total d'atomes H : cela conduit à 3H+ ;
petit intérêt de la méthode : tu peux t'auto-corriger : en effet, sauf erreur de ta part, tu dois vérifier la conservation des charges électriques.
Il ne te reste plus qu'à multiplier tous les coefficients par 2 si tu tiens à éviter les coefficients stchiométriques fractionnaires et à rajouter les ions indifférents si tu le juges nécessaire.
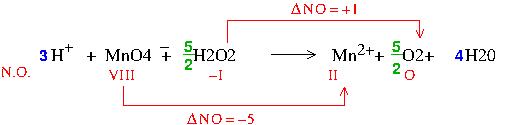
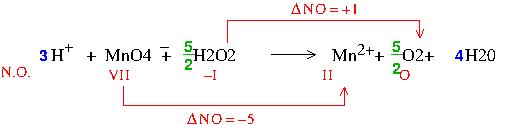
Étourderie sur mon schéma mais sans conséquence sur le reste : le nombre d'oxydation de l'élément manganèse passe de VII à II, ce qui fait bien une diminution de 5 comme écrit dans le message mais sous le symbole de Mn, mon schéma devrait montrer VII et non VIII.
Toutes mes excuses...
Merci énormément à vous tous pour ces reponses! Cela va vraiment beaucoup m'aider. Le plus difficile je trouve, est de trouver le reducteur et l'oxydant...
Pour résumer, une fois que j'ai trouvé les couples je fais mes demi-équations en faisant abstraction des H20? Mais je comprends pas le fait de rajouter à la fin les K+ et les SO4... Je m'excuse pour toutes ces questions!
Mais je comprends pas le fait de rajouter à la fin les K+ et les SO42-...
Moi non plus ! La réaction s'effectuant en solution aqueuse, les ions potassium et sulfate sont là pour assurer l'électroneûtralité de la solution mais ils ne participent pas à la réaction ; il n'y a pas de raison de les faire figurer dans l'équation bilan. Il est d'ailleurs très bizarre d'utiliser les formules brutes pour des composés ioniques en solution aqueuse. La molécule H2SO4 n'exste pas dans l'eau... Bref , je ne sais pas quel type d'étude tu fais et je crois que tu as intérêt à faire comme le demande ton professeur, mais, de mon point de vue, il serait préférable d'écrire l'équation bilan sous la forme :
6H+aq + 2 MnO4- + 5H2O2
 2Mn2+ +8H20 + 5O2
2Mn2+ +8H20 + 5O2Je suis en première année de médecine et le professeur demande de mettre également les K+ d'où ma question de savoir comment les rajouter et où, sans se tromper...
Je suis en première année de médecine
C'est bien ce que je soupçonnais... Je ne ferai pas de commentaire désagréable sur l'enseignement des sciences physiques à ce niveau : s'il s'agit toujours aux concours de QCM mieux vaut faire à la lettre ce que demande le professeur même si....
L'énoncé précise que parmi les réactifs, il y a de permanganate de potassium ; ce composé ionique est électriquement neutre et contient autant d'ions K+ que d'ions MnO4-
L'énoncé précise aussi que la solution contient aussi de l'acide sulfurique : pour être électriquement neutre, sa solution doit contenir deux fois plus d'ions H+aq que d'ions sulfates d'où l'équation avec les ions indifférents :
6H+aq +3SO42-+ 2K+ + 2 MnO4- + 5H2O2
 2Mn2+ 2SO42- +8H20 + 5O2 + 2K+ + SO42-
2Mn2+ 2SO42- +8H20 + 5O2 + 2K+ + SO42-
Comme déjà expliqué, le passage aux formules brutes en solution aqueuse est faux mais si ton professeur le demande, fais-le jusqu'à ta réussite au concours !
Merci beaucoup ! Je suis d'accord pour l'enseignement, il faut s'accrocher... J'ai vraiment du mal avec ce cours ! Pourquoi dans certaines réactions les deux oxydants sont du même côté ? Ce n'est pas du côté opposé normalement ?
Une réaction d'oxydo réduction fait toujours intervenir comme réactif l'oxydant d'un couple (ici MnO4-) et le réducteur d'un autre couple (ici H2O2).
La confusion chez toi vient peut-être du fait que, suivant les conditions, une espèce peut se comporter comme un oxydant ou comme un réducteur. Par exemple, H2O2 en présence de MnO4- qui est un oxydant très fort, se comporte en réducteur du couple (O2/H2O2) ; en revanche, en présence d'un réducteur, H2O2 se comporte comme l'oxydant du couple (H2O2/H2O). Tu as aussi des ions comme l'ion nitrate NO3- ou l'ion sulfate, qui peuvent se comporter en oxydant ou - comme ici pour l'ion sulfate - se comporter en ions spectateurs. Pour savoir quelle est la réaction spontanée, il faut classer les couples oxydant/réducteur par potentiels standard croissants puis voir si la règle du gamma s'applique à un oxydant d'un couple et à un réducteur d'un autre couple, ce réducteur et cet oxydant étant bien sûr des réactifs.


