Inscription / Connexion Nouveau Sujet
Dosage de la solution de soude
Bonjour
Je ne comprends pas (et par la même occasion je n'arrive pas) la résolution de cet exercice ! Pourriez vous m'éclairer ? Merci d'avance 
Introduire la solution de soude NaOH dans la burette. Verser Va=10mL de la solution de HCl de concentration Ca= 0,2M dans un erlenmeyer contenant 100mL d'eau.
Ajouter quelques gouttes d'indicateur coloré et dose cette solution par addition d'un volume V de solutions de NaOH à la burette.
En déduire la concentration Cbde la solution de NaOH et tenir compte du titre trouver pour les calculs ultérieurs.
Donner la relation liant Ca, Va, Cb et V
En déduire Cb.
Merci 
Salut,
Les dosages font partie du programme du lycée, je te conseille donc de relire un peu le cours sur le sujet :
![]() [lien]
[lien]
J'attends ensuite tes propositions, c'est une question ultra classique qu'il faut que tu saches refaire sans hésiter.

Bonjour
Au fur et à mesure où tu ajoutes les ions hydroxyde (concentration Cb) dans la solution acide, tu obtiens une réaction totale :
Tant que CaVa>CbV des ions H+ reste en solution : la solution est acide. l'indicateur a une certaine couleur.
Dès que CbV>CaVa la solution va devenir basique : les ions hydroxyde ajoutés en excès vont rester en solution. L'indicateur prend une couleur différente. Le changement de couleur, appelé "virage" de l'indicateur correspond au cas particulier CaVa=CbV. Ce volume particulier est appelé "volume équivalent". La mesure de ce volume équivalent permet de déterminer une concentration si l'autre concentration a une valeur connue.
Ai - je bien compris ?
On fait un dosage
On met la soude dans la burette de concentration Cb, le Volume Vb de la soude sera a déteminer à l'équivalence (indiquée par le virage coloré) sur la burette.
En dessous de la burette, on met un erlenmeyer contenant un volume Va de 10 mL, et de concentration de 0,2 M (Hcl)
dans cet même erlenmeyer, on a aussi 100 mL d'eau
Quand on aura déterminé Vb, on pourra déterminer Cb
Je comprends pas pq on met de l'eau ??
Car ça change tout le calcul?
Car sans l'eau, à l'équivalence, on a Ca*Va = Cb*Vb, soit Cb = Ca*Va / Vb
Ajouter de l'eau à un double intérêt pratique :
1° les électrodes du pH-mètre sont recouvertes plus complètement, ce qui favorise la précision de la mesure du pH si on utilise un pH-mètre.
2° la variation de pH au voisinage de l'équivalence est plus "rapide", ce qui favorise la précision du repérage du volume équivalent, soit à l'aide d'un indicateur coloré soit à l'aide du pH-mètre.
Cette eau, ne modifie pas le calcul des quantités d'acide et de base.
Cela dit, je ne peut que t'inciter à suivre les conseils de gbm !
D'accord ! merci bcp  J'y vois un peu plus clair
J'y vois un peu plus clair
Ici, on a dosé avec un indicateur coloré, c'est donc un titrage colorimétrique c'est ça ? 
Dans la suite du TP, je dois faire un dosage d'une solution saturée de NH4Cl
- Noter la température de la solution saturée de NH4Cl
- Prélever à l'aide d'une pipette 20mL du surnageant de la solution saturée de NH4Cl solide dans l'éthanol, les verser dans une fiole jaugée de 50 mL et compléter jusqu'au trait de jauge avec l'eau distillée. Agiter puis verser les 50 mL de la solution de NH4Cl dans un becher de petit diamètre. Plonger la cellule de conductimètrie. Placer sous agitation constante.
Mettre le conductimètre sous tension
Noter la valeur de la conductivité après stabilisation
Ajpouter à la solution 1 ml de NaOH. Attendre 30 sec, puis noter la conductivité.
Poursuivre le dosage de la même facon, et continuer le dosage avec 7-8 ajouts de solution de NaOH après le début d'une brusque augmentation de conductivité
Résultats :
Etablir un tableau selon le modèle suivant :
V (mL) 
 ' =
' =  .(V°+V)V°
.(V°+V)V°
0
1
2
...
1°) Petite question : La burette étant graduée de 25mL, je dois faire 26 colonnes dans mon tableau (avec le volume 0 mL) ?
2°) Ensuite je dois tracer le graph  ' = f(V)
' = f(V)
Pourquoi ne pas faire directement  =f(V) ? Je ne comprends pas à quoi sert
=f(V) ? Je ne comprends pas à quoi sert  '
'
Enfin, soit Ca la concentration de NH4Cl de la solution saturée de Nh4Cl
Donner la formule liant Va, Ca, Veq et Cb
3°) Ici, c'est comme tout à l'heure ?
Vu qu'on est à l'équilibre ? CbVeq = VaCa
à partir de la, je dois en déduire la solubilité de NH4Cl dans l'éthanol
4°) Je sais que S = n/V
Mais ici, je ne sais pas si on doit prendre CaVa ou CbVeq pour N ?
Et le Volume ? On prend quoi
Je dois calculer cette solubilité en mol/L puis en g/L
Mais je ne comprends pas comment faire ?
Après je dois comparer cette solubilité à celle de NH4Cl dans l'eau (facile, celle de l'eau est de 372g.L, j'aurais juste à comparer)
MErci davance du temps que vous m'accorder !!
La burette étant graduée de 25mL, je dois faire 26 colonnes dans mon tableau
Il faut commencer par comprendre le principe du dosage, sinon on raisonne à l'aveugle. La réaction quasi totale est :
NH4+ + HO-
 H2O + NH3
H2O + NH3
En fait, en conductimétrie, tous les ions, même ceux qui ne réagissent pas, contribue à l'expression de la conductivité ; il est préférable d'écrire :
NH4+ +Cl-+ Na+ + HO-
 H2O + NH3+Cl-+ Na+
H2O + NH3+Cl-+ Na+
Au cours du dosage, avant l'équivalence, l'ajout d'un ion Na+ et d'un ion HO- fait disparaître de la solution un ion NH4+ et apparaître un ion Na+. L'ion sodium ayant une conductivité molaire un peu plus faible que l'ion ammonium, la conductivité de la solution diminue. Dès que l'équivalence est dépassée, les ions Na+ et HO- que l'on continue d'introduire restent en solution, ce qui augmente fortement la conductivité. L'équivalence correspond donc au minimum de
 . Relis ton protocole : il faut ajouter la soude tous les mL tant que
. Relis ton protocole : il faut ajouter la soude tous les mL tant que  diminue puis faire 7 à 8 mesures au delà de l'équivalence, quand
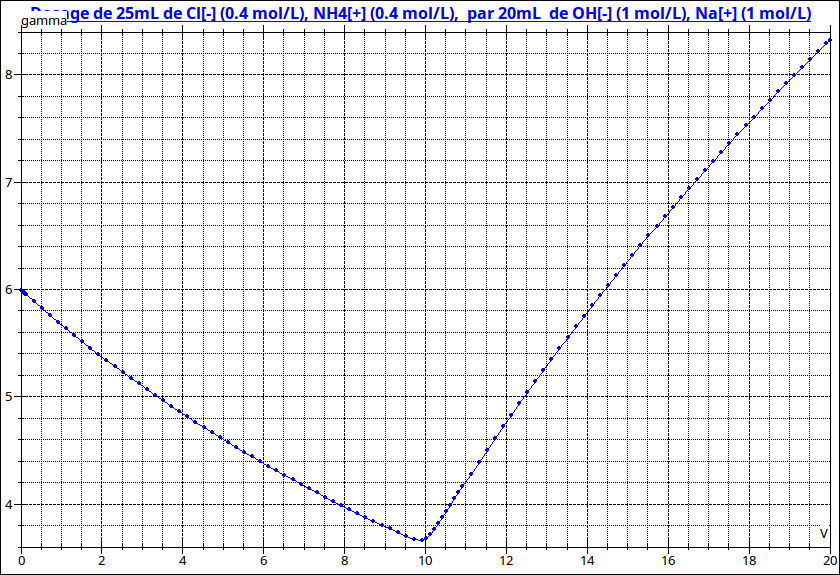
diminue puis faire 7 à 8 mesures au delà de l'équivalence, quand  augmente. Ignorant à l'avance le volume équivalent, tu ne peux pas connaître à l'avance le nombre de mesures...J'ai reproduit ci-dessous l'allure de la courbe
augmente. Ignorant à l'avance le volume équivalent, tu ne peux pas connaître à l'avance le nombre de mesures...J'ai reproduit ci-dessous l'allure de la courbe  =f(v). J'ai choisi des valeurs numériques au hasard : seule l'allure générale de la courbe est importante ici...
=f(v). J'ai choisi des valeurs numériques au hasard : seule l'allure générale de la courbe est importante ici...
Pourquoi ne pas faire directement
 =f(V) ? Je ne comprends pas à quoi sert
=f(V) ? Je ne comprends pas à quoi sert  '
' Il ne s'agirait pas plutôt de :
Si tu remplis un tableau d'avancement permettant d'obtenir les expressions des différentes concentrations avant et après l'équivalence, tu vas montrer que la courbe
 =f(v) correspond à une succession de deux branches d'hyperboles alors que la courbe
=f(v) correspond à une succession de deux branches d'hyperboles alors que la courbe  '=g(V) correspond à une succession de deux segments de droites. Plus facile dans le second cas de déterminer graphiquement le volume équivalent comme l'abscisse de l'intersection de ces deux segments.
'=g(V) correspond à une succession de deux segments de droites. Plus facile dans le second cas de déterminer graphiquement le volume équivalent comme l'abscisse de l'intersection de ces deux segments.
3°) Ici, c'est comme tout à l'heure ?
Oui : dans les deux cas la réaction est quasi totale et fait intervenir à l'équivalence autant d'acide que de base.
J'ai bien conscience que, par rapport au dosage précédent, le niveau a brutalement monté... J'ai réalisé il y a quelque temps une fiche sur les dosages acide-base par conductimétrie et pH-métrie. Le niveau est encore plus élevé que celui demandé ici mais tu pourras peut-être quand même y trouver de l'aide, en particulier pour remplir le tableau d'avancement avant et après l'équivalence. Il s'agit de la fiche n° 7 que tu trouveras ici :
Remarque : la conductivité que tu notes
 (sigma) est parfois notée
(sigma) est parfois notée  (gamma) : c'est ce que fait le logiciel que j'ai utilisé pour tracer la courbe...
(gamma) : c'est ce que fait le logiciel que j'ai utilisé pour tracer la courbe...
D'accord, merci bcp bcp pour vos explications. C'est plus clair pour moi 
Donc à l'équivalence, CB = CaVa/Veq
à partir de la, je dois en déduire la solubilité de NH4Cl dans l'éthanol
4°) Je sais que S = n/V
Mais ici, je ne sais pas si on doit prendre CaVa ou CbVeq pour N ?
Et le Volume ? On prend quoi ? Vt?
Je dois calculer cette solubilité en mol/L puis en g/L
Mais je ne comprends pas comment faire ?
5°) Ensuite, je dois calculer me Ks de H20 et de EtOH
Pour EtOH, j'aurais besoin de la solubilité de EtOH, que je n'arrive pas à calculer
Pour H20 :
NH4Cl -> NH4+ + Cl-
s s
Ks = s^2 = (372)^2 ????? Ca paraît enorme comme valeur de Ks?
Merci bcp du temps que vous m'accordez 
Mais ici, je ne sais pas si on doit prendre CaVa ou CbVeq pour N
Je ne comprends pas la question : à l'équivalence ces deux quantités sont égales : la quantité de chlorure d'ammonium dosée est égale à n = CaVa=CbVbeq.
Et le Volume ? On prend quoi ?
Si je lis bien le protocole, Va = 50mL mais la quantité n présente dans ce volume était initialement présente dans un volume V1=20mL de solution saturée. La solubilité est donc :
Ensuite, je dois calculer me Ks de H20 et de EtOH
Cette phrase révèle de nombreuses incompréhensions...
1° tu semble confondre la solubilité s et le produit de solubilité Ks...
2° il s'agit ici de comparer la solubilité s du chlorure d'ammonium dans l'éthanol (celle que tu viens de mesurer) à la solubilité du chlorure d'ammonium dans l'eau (celle qui t'est fournie).
Ah oui merci bcp !! je n'avais pas pensé qu'à l'équivalence les quantités de matières étaient égales !!
Je dois calculer cette solubilité en mol/L puis en g/L
Mais je ne comprends pas comment faire pour en g/L -1?
On a pas la masse ?
Ou alors je fais simplement s = m/V = (n*M)/V ?
Non non je ne confonds pas la solubilité s et le produit de solubilité Ks...
Après avoir calculé la solubilité de EtOH, je dois calculé le produit de solubilité Ks de e H20 et de EtOH !!
Pour H20 :
NH4Cl -> NH4+ + Cl-
s s
Pour H20 :
NH4Cl -> NH4+ + Cl-
s s
Ks = s^2 = (372)^2 ????? Ca paraît enorme comme valeur de Ks?
Merci 
Après avoir calculé la solubilité de EtOH, je dois calculé le produit de solubilité Ks de e H20 et de EtOH
Tu n'as pas bien compris mon message précédent : il s'agit de calculer le produit de solubilité de NH4Cl dans l'eau puis le produit de solubilité de NH4Cl dans l'alcool. NH4Cl est très soluble... Les valeurs de Ks sont très élevées mais ce calcul n'a guère de sens ici. L'expression de Ks en fonction des concentrations que tu utilises n'est correcte qu'en solutions diluées, sinon, il faut faire intervenir les activités, ce qui n'est sans doute pas à ton programme. Le calcul de Ks à partir de la formule que tu utilises n'est possible que pour les solides très peu solubles, ce qui n'est pas le cas de NH4Cl dans l'eau...
D'accord ! mais je n'ai jamais vu comment calculer cela dans mes cours :/
Et pour la solubilité, tu peux m'eclairer s'il te plaît ? 
Bonjour
Pour la solubilité je t'ai demandé comment je pouvais passer en g/L sachant que je n'avais pas la masse et tu ne m'as répondu que pour la solubilité en mol/L,
Cest pour ca que je te re demande
Merci d'avance
Bonjour
Ayant la solubilité exprimée en mol/L, il faut multiplier par la masse molaire (exprimée en g/mol) pour avoir la solubilité en g/L
d'accord merci
Pouvez vous etre plus claire sur la constante que je dois calculer ?
j'aimerais vraiment comprendre...
Quel constante utiliser ici si ce n'est pas le Ks ? Et comment la calculer ?
Merci d'avance
bonsoir
Tu peux calculer la solubilité "s" sans problème, que la solution soit concentrée ou non. En revanche, le produit de solubilité ne peut être calculé, à ce niveau d'enseignement, que pour les solutions diluées. La relation Ks=s2 avec s en mol/L n'est valide que pour les solutions diluées (s<0,1mol/L). Pour les solutions plus concentrées, la relation entre s et Ks est beaucoup plus compliquée et n'est sûrement pas à ton programme. Tu ne peux donc pas calculer Ks pour une solution concentrée... Je t'ai déjà parlé de cela dans mon message du 06-10-16 à 15:36.


