Inscription / Connexion Nouveau Sujet
calculs de masse et de litres
Bonjour,
Voici 2 exercices don je ne suis pas sûre de la réponse.
Exercice 1
le monoxyde de carbone ses combine à l'oxygène pour former le dioxyde de carbone. ces trois substances sont des gaz. le volume de CO2 obtenu par la réaction entre 2 litres de CO et 1 litre d'O2 est de: a.5,48g b. 9,00g c. 16,00g et d. 22,00g.
CO +O2 ---> CO2
2CO +O2 ---> 2CO2
2 mol de CO réagissent avec 1 mol de O2 pour donner 2 mol de CO2.
Voir PJ
calculs proportionnels:
44,8L/2L = 44,8L/x
44,8x = 89,6L
x= 1,998... soit  2L réponse : b= 2 litres.
2L réponse : b= 2 litres.
Exercice 2
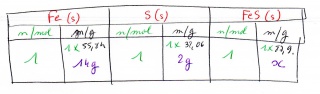
Le fer et le soufre se combinent pour former le sufure de fer: Fe(s) +S(s) ---> FeS(s). La masse de sulfure de fer obtenue en faisant réagir 14,00g de fer et 2,00g de soufre est:
a.5,48g b. 9,00g c. 16,00g d. 22,00g
Fe(s) +S(s) ---> FeS(s)
1mol de Fe réagissent avec 1 mol de S pour donner 1 mol de FeS
Voir 2e PJ
si je fais ceci 55,84/14 = 87,9/x ===> 55,84x= 1230,6 ===> x= 22,03
et: 32/2 = 87,9/x ===> 32x=175,8 ===> x = 5,48
Là je m'embrouille
merci de votre aide
Mamie
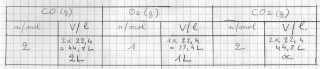
Bonjour,
L'exercice n°1 est très mal posé.
- il confond l'oxygène (O) et le dioxygène (O2).
- il ne précise pas les conditions de pression et de température permettant de remonter à la masse de dioxyde de carbone formé. Même si tes calculs semblent indiqué que tu es dans les CNTP avec le volume molaire égal à Vm = 22.4 L/mol.
Ton calcul est inutile. En effet, dans les mêmes conditions de température et de pression (chose que tu admets en faisant tes calculs), la quantité de matière et le volume occupé sont proportionnels.
Or, on part dans les proportions stchiométriques des deux réactifs.
Donc, on obtient 2 L de dioxyde de carbone dans les CNTP.
Par contre, je ne suis pas d'accord avec les masses (sachant que l'énoncé parle de volume).
D'où ma question : as tu bien recopié l'énoncé ?
Merci Boltzmann_Solver
Oui l'énoncé est correct, sauf la partie des réponses , je me suis trompé d'exercice ( réponses de l'exercice )
le monoxyde de carbone ses combine à l'oxygène pour former le dioxyde de carbone. ces trois substances sont des gaz.
le volume de CO2 obtenu par la réaction entre 2 litres de CO et 1 litre d'O2 est de: a.1 litre b.2 litres c. 3 litres et d. 4 litres
Merci Boltzmann_Solver
Oui l'énoncé est correct, sauf la partie des réponses , je me suis trompé d'exercice ( réponses de l'exercice 2)
le monoxyde de carbone ses combine à l'oxygène pour former le dioxyde de carbone. ces trois substances sont des gaz.
le volume de CO2 obtenu par la réaction entre 2 litres de CO et 1 litre d'O2 est de: a.1 litre b.2 litres c. 3 litres et d. 4 litres
Pour l'exercice n°2, la méthodologie du tableau d'avancement n'est pas maitrisée. Si vous êtes en seconde, le tableau est hors programme (mais parfois abordé). L'idée du tableau est de chercher le nombre de fois que l'on peut réaliser une équation de réaction. Je pars du principe que vous êtes en seconde.
Ici, on a Fe + S -> FeS. Donc en moyenne, si on met en présence un atome de fer et un atome de soufre, on obtient une portion du solide ionique FeS.
Trois cas possibles :
- on dispose de plus de fer que de soufre, la réaction s'arrête quand on a entièrement consommé le soufre.
- on dispose autant de fer que de soufre, la réaction s'arrête quand on a entièrement consommé les réactifs.
- on dispose de moins de fer que de soufre, la réaction s'arrête quand on a entièrement consommé le fer.
Au regard des données, combien de fois (en moles) peut-on faire la réaction avec le fer ? Avec le soufre ?
En fait , je ne suis pas en seconde, je suis juste une mamie en reprises d'études.,Je ne connais pas le tableau d'avancement.
Il y a autant de moles de fer que de soufre?
Bonjour,
Oups, mon dernier message n'est pas passé...
Je vais le retaper.
Votre affirmation est péremptoire. Si c'est le cas, prouvez le moi en calculant les dites quantités de matière.
A partir de là, vous pourrez me dire dans quel cas on se situe. Puis en déduire le nombre de fois qu'on pourra réaliser l'équation de la réaction.
Masse molaire:
fer : M(Fe) = 56g.mol-1
soufre: M(S) = 32g.mol-1
Quantité de matière:
n=m/M donc :
n(Fe) = m(Fe)/M(Fe)= 14,00g/56g.mol-1 = 0,25 mol
n(S) = m(S)/M(S)= 2,00g/32g.mol-1 = 0,0625 mol
Il y a donc plus de fer que de soufre.
Puis en déduire le nombre de fois qu'on pourra réaliser l'équation de la réaction.
L'équation de la réaction est Fe + S -> FeS. Pourriez vous me traduire littéralement cette équation ?
0,25 mol de Fe réagissent avec 0,0625 mol de soufre pour donner x mol de FeS.
Le réactif limitant est le fer
la masse de FeS produite :
m(FeS) = n(FeS) * M(FeS) = 0,00625*(1*56+2*16) = 5,5 mol
Bonjour,
Vous n'avez pas répondu à ma question. Comment vous aider efficacement si vous vous lancez bille en tête dans un calcul ?
0,25 mol de Fe réagissent avec 0,0625 mol de soufre pour donner x mol de FeS.
Cette phrase est fausse physiquement et est en contradiction avec la citation ci-dessous.
Le réactif limitant est le fer.
Le calcul ci-après est à peu près juste mais très mal rédigé. Je m'explique :
Déjà, il convient de distinguer dans quel état du système vous vous situez. Ici, il s'agit de l'état final qui se confond avec l'état maximal (ce point est limite pour un niveau second mais je le fais en classe). Pour le distinguer, je mets un f en exposant.
mf(FeS) = nf(FeS) * M(FeS) = 0,00625*(1*56+2*1632) = 5,5 mol
Ensuite, l'unité est fausse. Mais j'ose croire que c'est une étourderie. Un conseil de rédaction pour éviter ces fautes, c'est de marquer les unités partout :
2g/(32,065g/mol)*(55,845g/mol+32,065g/mol) = 5,48 g car les g/mol se simplifient.
Après 0.0625 mol au lieu de 0.00625 mol avec des masses molaires trop approximées au regard des réponses proposées et de la précision des mesures.
Pour finir, le 2*16 est impropre dans le sens où l'on pourrait croire que vous utilisez la masse molaire atomique de l'oxygène.
Voilou
 . J'espère que ça vous aidera.
. J'espère que ça vous aidera.Bonjour,
Cela fait 2 jours que j'essaie de comprendre et ce n'est pas facile pour moi, mais comme je suis persévérante je sais que j'y arriverai.
Les petites erreurs que vous avez trouvé sont des étourderies
Après 0.0625 mol au lieu de 0.00625 mol
J'ai involontairement rajouté un 0
0,00625*(1*56+2*16)
Je ne sais pas où j'avais la tête à ce moment

En réfléchissant, un peu,
 je déduis que le réactif limitant est le soufre et il détermine la proportion à respecter et il y aura un excès de fer.
je déduis que le réactif limitant est le soufre et il détermine la proportion à respecter et il y aura un excès de fer.
Donc , en effet la réponse est 5,48g.
Je vous remercie de votre aide et excusez-moi de mes hésitations et erreurs.



