Inscription / Connexion Nouveau Sujet
calcul de masse
Bonjour,
Je suis actuellement en TST2S
J'ai des difficultés à réaliser cet exercice :
On réalise l'hydrolyse de l'oléine en présence d'un excès d'eau;
1. Ecrire l'équation de la réaction
2. Nommer les produits formés
3. On fait réagir une masse d'oléine m(olé)=1000kg.
En supposant la réaction totale, déterminer la masse d'acide gras formé.
Données : masse molaire de l'oléine M=884 g/mol
Pour la 1, je n'ai pas de problème. La 2 c'est l'acide oléique et le glycérol.
Mais pour la 3, j'ai beau essayer tous les calculs, je trouve des résultats incohérents.
D'avance merci
Bonjour
Tu sais que la réaction est totale donc à l'état final tu n'auras plus d'oléine et la totalité d'oléine a été consommé xmax=no (no étant la quantité initiale d'oléine soit m/M)
Donc n(acide oléique)final=xmax=no
Tous ceci car réaction totale
Ah oui et l'acide gras c'est l'acide oléique (peut être que c'est cela qui te bloquer !)
Tous ce que j'ai dit peut (et DOIT) être résumé par un tableau d'avancement.
Ah oui bien sur je ne connais pas les formules des espèces que je viens de citer . Je ne sais pas si dans ton exercice on te les donne.
En tout cas il faut bien équilibré la réaction et si il y a des coefficients devant les espèces ne pas oublier de les mettre dans le tableau d'avancement
J'espere que j'ai été clair et que tu comprend mieux !! 
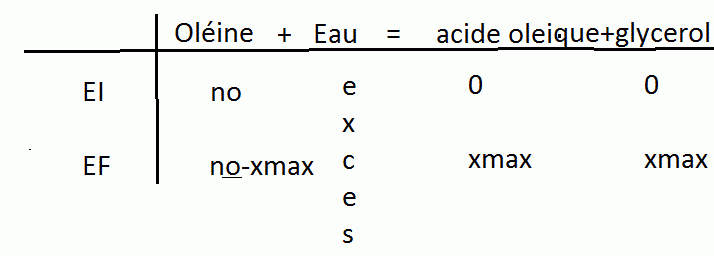
Merci pour votre réponse complète, mais je suis désolée, je ne parviens toujours pas au résultat.
Je n'ai jamais vu les tableaux d'avancement mais j'ai tout de même compris.
En revanche, mon professeur m'a guidé en me disant qu'il fallait d'abord calculer la quantité de matière d'oléine, puis la quantité de matière de l'acide oléique et enfin la masse de cet acide formé, qui est la réponse à la question.
Sachant que l'énoncé ne nous fournit que la masse d'oléine introduite qui est de 1000kg ainsi que la masse molaire de 884 g/mol, je n'arrive toujours pas à conclure...
---> n(olé)= m / M il suffit de remplacer donc pas de problème.
Mais pour la quantité de matière de l'acide oléique, je n'y arrive pas
Je ne savais pas que tu n'avais pas encore vu les tableaux d'avancement.
Mais ce n'est pas grave .
Effectivement tu calcules la quantité de matière d'oléine introduite à l'état initial (que j'appelle no) avec la formule
n=m/M m:la masse en g (pour que au final tu obtiennes bien des moles) M:la masse molaire en g/mol
Ensuite tu utilises la donnée de l'énonce sur le fait que la réaction est totale
Réaction totale: Une réaction est totale si au moins un des réactifs a disparue au cours de la réaction .
Ici notre réactif est l'oléine (l'eau étant en excès ) . Ce qui signifie que la totalité de réactif introduit au départ (c'est à dire ton no) s'est transforme en acide gras (ton acide oléique)
Ainsi n(acide gras)=no
Ensuite pour avoir la masse tu réutilise ta formule du départ en faisant un simple produit en croix (m=n*M)
Et normalement dans l'énoncé on te fournie la masse molaire de l'acide gras (l'acide oléique) ou bien il suffit que tu regardes sur le net
J'espère que c'est plus clair si tu comprend toujours pas n'hésite pas !


