Inscription / Connexion Nouveau Sujet
avancement d'une réaction
Bonjour,
Je viens de faire un exercice concernant l'avancement d'une réaction, et j'aimerais savoir si ce que j'ai fais est correct...
Voici l'énoncé de l'exercice :
On réalise la combustion complète de l'éthane C2H6 dans le dioxygène. Le mélange initial renferme 0,50 mol d'éthane et 1,40 mol de dioxygène.
1. Ecrire l'équation de la réaction en utilisant des nombres stoechiométriques entiers les plus petits possibles
2. Déterminer, à l'aide d'un tableau d'avancement, l'avancement maximal et le réactif limitant
3. En déduire, la composition du système dans l'état final en supposant l'avancement maximal atteint.
Voici ce que j'ai fais :
1.
2 C2H6 + 7 O2 -----> 4 CO2 + 6 H2O
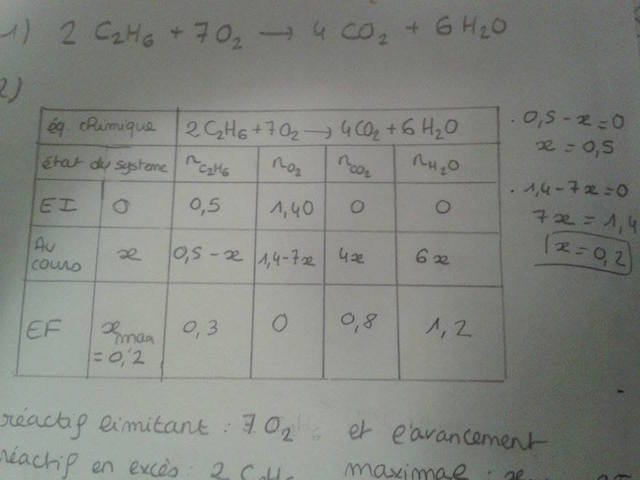
2. J'ai fais un tableau d'avancement :
Equation chimique 2 C2H6 + 7 O2 ----------> 4 CO2 + 6 H2O
Etat du système nC2H6 nO2 nCO2 nH2O
EI 0 0,5 1,40 0 0
Au cours x 0,5 - x 1,40 - 7x 4x 6x
EF xmax= 0,2 0,3 0 0,8 1,2
Pour déterminer xmax, j'ai fais :
- 0,5 - x = 0 donc x= 0,5
- 1,4 - 7x = 0 donc x= 0,2
Le x max est le plus petit, soit ici, 0,2
Le réactif limitant est alors : 7 02
Le réactif en excès (non demandé dans la consigne...) : 2 C2H6
et l'avancement maximal est : xmax = 0,2 mol
3. Composition du système:
L'O2 est le réactif limitant, le système est alors composé de :
0,3 mol de 2 C2H6
0,8 mol de 4 CO2 et de 1,2 mol de 6 H2O
Voilà, j'espère avoir juste.. et j'espère avoir des réponses, afin de confirmer mes doutes
Merci
Chloé
2 C2H6 + 7 O2 -----> 4 CO2 + 6 H2O
Si on a 0,5 mol de C2H6, une réaction complète nécessiterait : 0,5 * 7/2 = 1,75 mol de O2
Comme on ne dispose que de 1,40 mol de O2, c'est donc le O2 qui le réactif limitant.
-----
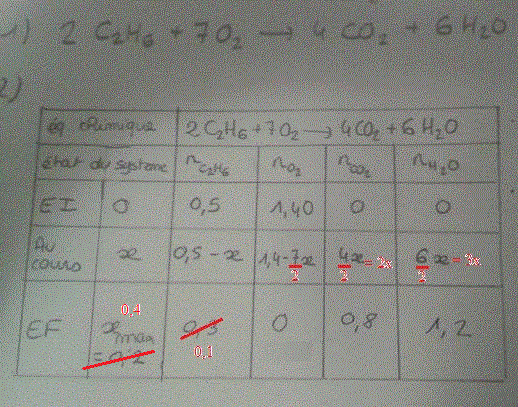
1,40 mol de O2 peut réaliser la combustion de 2/7 * 1,4 = 0,4 mol de C2H6
Et il sera alors produit : 4/2 * 0,4 = 0,8 mol de CO2 et 6/2 * 0,4 = 1,2 mol de H2O
Il restera aussi 0,5 - 0,4 = 0,1 mol de C2H6
La réaction sera : 0,50 C2H6 + 1,40 O2 ---> 0,8 CO2 + 1,2 H2O + 0,1 C2H6
-----
En utilisant un tableau d'avancement, j'aurais fait ceci :

Oui mais je dois utiliser des nombres stoechiométriques entiers...
Cà c'est uniquement pour la première question.
Ensuite, puisque l'énoncé impose des quantités de matière de 0,5 mol et de 1,4 mol, il n'est évidemment pas question de continuer avec des entiers.