Inscription / Connexion Nouveau Sujet
Alcanes
Bonsoir de l'aide svp.
La combustion d'un alcane fournit 2,8 l de C02 volume mesuré dans les CNTP . Trouver la formule brute de cet alcane.
MERCI D'AVANCE
Bonjour.
Quelques pistes en attendant vos propositions...
Quelle est la formule générale d'un alcane ?
Quelle est l'équation de la réaction de combustion complète d'un alcane ?
A vous.
Bonjour saturnelick : Formule générale des hydrocarbures saturés = CnH2n+2
Equation de combustion : C + O2 =====> CO2
1 mole de carbone ( 12g ) correspond à 1 mole de CO2 soit 22,4 litres
2,8 litres de CO2 correspond à ( 12 x 2,8 : 22,4 ) = 1,5g de carbone .
1,5g de carbone = 1,5 : 12 = 0,125 mol de carbone .
0,125 mole de carbone correspond à 0,125 mole de CH4 , soit 2g de méthane .
Vérification : CH4 + 2 O2 =====> CO2 + 2 H2O .
1mole de CH4 ( 16g ) donne par combustion 22,4 litres de CO2 .
0,125 mole de CH4 ( 2g ) donne par combustion ( 22,4 x 0,125 : 1 ) = 2,8 litres CO2 .
Bonnes salutations .
Les genies existent toujours...merci Molecule 10..franchement je sais pas comment te remercier pour laide que tu me pretes sur ce forum...merci�🙋
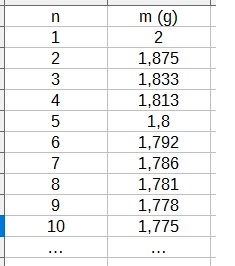
Mais dans la correction on a résolu de cette manière:
(14n+2)/1,8 = 22,4n/2,8 d'où n = 5
J'ai pas compris
Bonjour à tous les deux.
@saturnelick, l'énoncé que vous avez posté est incomplet ; vous indiquez bien le volume de dioxyde de carbone obtenu, mais vous ne donnez aucune information concernant la quantité d'alcane qui a brûlé.
Il y a, dans ces conditions deux inconnues et une seule équation...
Quand je regarde la correction que vous donnez dans votre post du 20/11 à 16 h 38...
(14n+2)/1,8 = 22,4n/2,8
Cela change tout, sans cette information, n'importe quel alcane aurait pu faire l'affaire !
Au revoir.