Inscription / Connexion Nouveau Sujet
Intéractions fondamentales
Bonjour, je n'arrive pas à faire cet exercice étant donné que je n'ai pas toute la leçon. Le voici :
Déterminer en justifiant votre réponse si les molécules suivantes sont apolaires ou polaires :
Dans le cas des molécules polaires vous ferez apparaître les charges partielles sur chaque atome.
a) CH3-CH2-CH2-Cl
b) CH3-O-CH3
c) CO2
d) CH4
e)CCl4
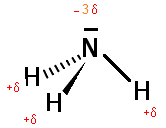
f) NH3
Choisir le bon solvant pour dissoudre le bon solide :
Solvant : solide :
eau (fortement polaire ) diiode ( l2 )
cyclohexane ( apolaire) chlorure de césium ( CsCl )
éthanol ( polaire)
pentane (apolaire)
Données:  (C)=2.4
(C)=2.4
 (O)=3.4
(O)=3.4
 (H)=2.1
(H)=2.1
 (Cl)=3.0
(Cl)=3.0
 (N)=3.0
(N)=3.0
Merci pour votre aide.