Inscription / Connexion Nouveau Sujet
Dosage du glucose dans un jus de fruit
Bonjour j'ai un problème avec cet exercice si quelqu'un pouvait m'aider à le résoudre ça serait gentil merci.
On réalise le dosage du glucose C6H12O6 contenu dans un jus de fruit par la méthode de comparaison.
Voici le protocole :
- On prépare une solution S de jus de fruit dilué en prélevant 25 mL de jus de fruit que l'on introduit dans une fiole jaugée de 200 mL, puis on complète avec de l'eau distilée;
- On procède ensuite à l'étalonnage de la liqueur de Fehling par une solution étalon S0 de glucose de concentration C0=2,5*10-2mol.L-1.
- Pour finir, on procède au dosage de la solution de jus de fruit en utilisant le même volume de liqueur de Fehling.
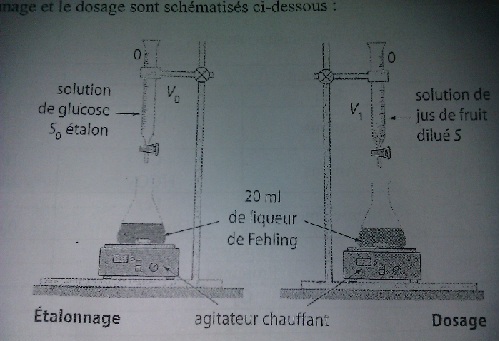
L'étalonnage et le dosage sont schématisés ci-dessous.
L'expérimenteur est parvenu au résultat suivant :
- "il faut verser un volume V0=12 mL pour faire virer entièrement la liqueur de Fehling lors de l'étalonnage.
- Il faut verser un volume V1= 16,1 mL pour faire entièrement la liqueur de Fehling lors du dosage."
1. Donner le principe du dosage par comparaison. (je ne comprend pas la question)
2. Déterminer la concentration molaire C1 en glucose de la solution S.
3. En tenant compte de la dilution effectuée pour préparer S, déterminer la concentration molaire C du glucose dans le jus de fruit.
4. En déduire sa concentration massique.
5. Décrire le protocole de la préparation de 100mL de solution étalon S0 du glucose à partir de glucose solide.
Données: M(O)=16.0g.mol-1 ; M(C)= 12.0g.mol-1 ; M(H)= 1.00g.mol-1
Merci d'avance 

Bonjour nirosane : Masse moléculaire du glucose C6H12O6 = 180 .
Deux solutions aqueuses sont préparées et mélangées à part égale, à la demande, pour former la liqueur de Fehling qui se conserve environ 18 mois 1,2 .
solution 1 : 35 g de sulfate de cuivre (CuSO4) dans 500 ml d'eau distillée (solution saturée).
solution 2 : 173 g de sel de Seignette (tartrate de sodium et de potassium, KNaC4H4O6 ) et 60g d'hydroxyde de sodium pur (NaOH) dans 500 ml d'eau distillée.
La solution 2 sert comme solution tampon car la solution est acide .
Au cours de la réaction, l'ion cuivre (II) oxyde la fonction aldéhyde du glucose pour donner un acide carboxylique sous sa forme basique (ion carboxylate), et un précipité rouge brique d'oxyde
de cuivre(I) Cu2O selon l'équation d'oxydo-réduction :
R-CHO + 2Cu++(aq) + 5HO-(aq) ====> RCOO- + Cu2O(s) + 3H2O .
20 ml de liqueur de Fehling sont exactement réduit par 0,1g de glucose .
Solution de jus de fruit (S) = 25ml de jus dans 200 ml de solution aqueuse .
Solution étalonnage de glucose C0=2,5*10-2mol.L-1. ou solution 0,025 molaire de glucose = 0,025 x 180 = 4,5g par litre de solution .
Pour l'étalonnage on a utilisé 12 ml de liqueur de Fehling soit ( 12 x 0,1 : 20 ) = 0,06g de glucose .
Pour la réaction on a utilisé 16,1 ml de liqueur de Fehling soit ( 16,1 x 0,06 : 12 ) = 0,0805g de glucose .
Dans 25 ml de jus de fruit on a 0,0805g soit ( 0,0805 : 180 )= 0,4472 mmol de glucose ou 0,0805 : 25 x 100 = 0,322% .
Dans un litre de jus de fruit , on a 3,22g de glucose soit 3,22 : 180 = 0,01788 mole .
Remarque : une autre méthode d'analyse consiste par la gravimétrie : on filtre le Cu2O formé . Dans l'équation tu vois que 1 mole de glucose forme 1 mole de Cu2O solide ( = 143g ). Donc par
une règle de trois , tu trouves la quantité de glucose .
Voilà je te laisse finir ton exercice comme tu l'entends . Bonnes salutations .


