Inscription / Connexion Nouveau Sujet
Molécule polaire apolaire, et ou linéaire
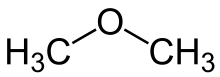
Bonjour à tous, voilà j'ai un dm à réaliser pendant les vacances et j'aimerais savoir si la molécule de méthoxyméthane est linéaire, si oui est-elle apolaire ou polaire ? Merci de votre réponse
Bonjour.
j'aimerais savoir si la molécule de méthoxyméthane est linéaire
est-elle apolaire ou polaire ?
A plus.
Oui mais justement est-ce que dans une molécule linéaire la chaîne doit être droite ? Comme celle-ci (exempl).
De plus cette molécule possède comme liaison polaire O-C. Mais si la molécule est linéaire alors le centre des charges positives coïncide avec le centre des charges négatives et donc la molécule est apolaire.

La molécule de méthoxymethane est coudée et polaire du fait de la différence d'électronégativité entre les atomes O et C.
D'accord j'ai compris merci. Donc si j'ai bien compris la molécule suivante est polaire du fait de la différence d'électronégativité entre les liaisons c-O et du fait que le centre des charges positives ne coïncide pas avec le centre des charges négatives c'est bien ça
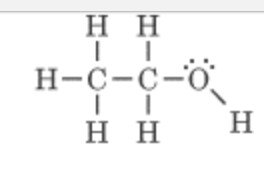
C'est bien cela !
En ce qui concerne la molécule de dioxyde de carbone elle est certes apolaire, mais on peut cependant attribuer une charge partielle - à chacun des atomes d'oxygène et une charge partielle +2
à chacun des atomes d'oxygène et une charge partielle +2 à l'atome de carbone.
à l'atome de carbone.
Dans cette molécule, les deux liaisons C=O sont polarisées, mais la molécule est apolaire.
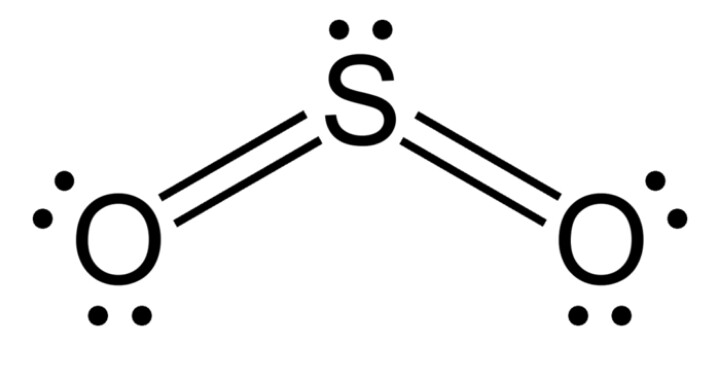
Pour ce qui est de SO2, l'oxygène est plus électronégatif que le soufre, mais la différence des électronégativités n'est pas très importante ; les liaisons S=O sont donc polarisées (- sur chaque O et +2
sur chaque O et +2 sur S).
sur S).
Comme la molécule est coudée, les barycentres des charges positives et négatives ne coïncident pas, la molécule est donc polaire (ou faiblement polaire).
C'est exactement ce que j'ai mis sur la copie mais le professeur à mis " non apolaire ".
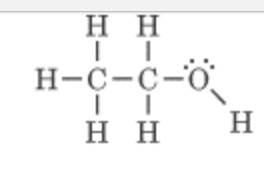
Une dernière question concernant la molécule suivante. Il n'existe qu'une seule interaction, c'est à dire liaison hydrogène c'est bien cela ? Les interactions de Van der Waals ne sont pas possiblent ?
le professeur à mis " non apolaire "
Il n'existe qu'une seule interaction, c'est à dire liaison hydrogène c'est bien cela ? Les interactions de Van der Waals ne sont pas possibles ?
Oui en fait je voulais pas dire non il a juste mis apolaire et il a barré mon polaire. Donc concernant la molécule, les deux interactions sont possibles c'est bien cela ?
Donc concernant la molécule, les deux interactions sont possibles c'est bien cela ?
Quant à la remarque de votre professeur sur la molécule de dioxyde de soufre, je ne sais que vous conseiller ; allez le voir pour des explications supplémentaires ou regardez le lien ci-dessous (le cas de SO2 est traité en bas de la page 5).
Voici le lien

Pour cette molécule, la règle de l'octet n'est pas respectée et c'est plus délicat que pour les exemples précédents (est-ce vraiment au programme de 1°S ?).