Inscription / Connexion Nouveau Sujet
Eau
Bonsoir, svpp aidez moi je ne comprend vraiment rien
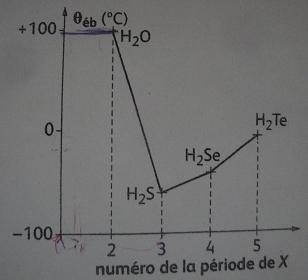
1) qui est la temperature d'ebulition de l'eau sous 1 bar ?
rep elle est superieur à 100°
2) Quelle devrait etre approximativement sa temperature d'ebulition si l'évollution etait reguliere
rep: 0°
3) Quel interaction existe à l'état liquide dans tous les composes
4) Expliquer pourquoi la temperature d'ébuliton de l'eau est si elevée
REP parceque elle est sous diffrentes formes
Merci
Bonjour.
1) qui est la temperature d'ebulition de l'eau sous 1 bar ?
rep elle est superieure à 100°
2) Quelle devrait être approximativement sa température d'ébullition si l'évolution était régulière
rep: 0°
Pour les deux dernières questions, votre réponse n'est pas très convaincante (je ne vois d'ailleurs pas trop ce que vous entendez par "formes différentes").
Allez donc fouiner un peu du côté des forces de Van der Waals et des liaisons hydrogène, vous devriez trouver des éléments pour une réponse plus pertinente.
Au revoir.
Je n'arrive pas à inserer mon graphique c'est pour cela qui manque des donnees .
Comment je peux faire ?
je voulais dire par differentes formes : solide , liquide , gazeux
Pour insérer votre graphique, scannez le à l'aide de Paint puis enregistrez le scan au format JPEG. Cliquez ensuite sur l'icone Img située en dessous de la fenêtre où vous tapez vos messages, puis, suivez la procédure indiquée (choisir un fichier, ouvrir, attacher etc.)
je voulais dire par différentes formes : solide , liquide , gazeux
je n'ai pas de scan mais je l'ai pris en photo et quand je clique sur attacher sa charge et apres ca ne fait rien
ah oui
Passez par Paint c'est un petit logiciel de traitement d'images, disponible sur tous les ordis ; si vous ne savez pas où il est, faites "rechercher".
2) Quelle devrait être approximativement sa température d'ébullition si l'évolution était régulière
Pour les autres questions, je vous ai déjà donné des pistes de recherche dans mon précédent message.
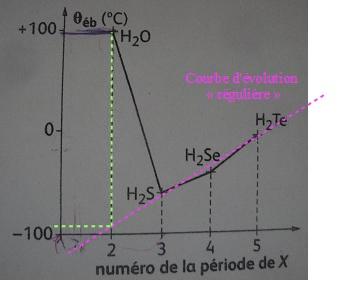
Si l'evolution etait reguliere la temperature d'ebulition devrait etre de -90° approximativement
1) sous 1 bar la temperature est de 100°
2) 90°
3) a l'etat liquide il ya des liasons hydrogene
4)
Si l'evolution etait reguliere la temperature d'ebulition devrait etre de -90° approximativement
2) 90°
3) a l'etat liquide il ya des liasons hydrogene
Dans tous les composés H2O, H2S, H2Se et H2Te, des forces de Van der Waals existent entre les molécules.
A quoi sont dues les liaisons hydrogène ? Sont-elles notables entre les molécules de tous les composés précédents ?
mais comment peut on savoir qu'il existe des forces de van der waals ? ??
la 4 je ne comprends pas pourquoi ce sont les liasons hydrogene qui sont responsable.
les liaison H se manifeste qu'avec des atomes très électronégatifs.
L'atome d'oxygène a une électronégativité nettement plus forte que celle de l'atome d'hydrogène (ce qui n'est pas le cas des électronégativités des éléments S, Se et Te). Les conditions sont donc réunies pour que des liaisons hydrogène s'établissent entre les molécules d'eau.
Du fait de ces liaisons hydrogène, les molécules d'eau forment des "paquets" qui se comportent alors comme des molécules beaucoup plus lourdes ; c'est pour cette raison que les températures de changement d'état de l'eau sont beaucoup plus élevées que celles des autres composés évoqués dans votre document.
Pour ce qui est des forces de Van der Waals, elles existent entre toutes les molécules (H2O, H2S, H2Se...), mais elles sont beaucoup moins intenses que les forces dues aux liaisons hydrogène.
Si votre professeur n'a pas évoqué ces forces de Van der Waals, ignorez les ; vous les retrouverez plus tard si vous poursuivez des études supérieures scientifiques.
ah d'acccord la consigne dit quel interaction existent à l'etat liquide
je regarde l'etait liquide c'est vers les 100 ° C ou il ya H20 il ya oxygne , oui je sais qu'il posses une electronegativite plus forte donc , j'en conclus qu'il ya des liasons hydrogene .
par contre je n'ai pas compris le "dans tous les composes " de la consigne !!
on a evoqué les forces de van der waals !
mais comment peut ton savoir que ce sont eux ?
par contre je n'ai pas compris le "dans tous les composes " de la consigne !!
on a evoqué les forces de van der waals !
mais comment peut ton savoir que ce sont eux ?
ah d'accooord !
4) Expliquer pourquoi la temperature d'ébuliton de l'eau est si elevée
je ne sais pas
ah oui "Du fait de ces liaisons hydrogène, les molécules d'eau forment des "paquets" qui se comportent alors comme des molécules beaucoup plus lourdes ; c'est pour cette raison que les températures de changement d'état de l'eau sont beaucoup plus élevées que celles des autres composés "
mais je ne comprends pas "que celles des autres composés évoqués dans votre document" ?
Les "paquets" de molécules dus aux liaisons hydrogène n'existent que pour l'eau.
Pour les autres composés, H2S, H2Se et H2Te, il n'ya pas de liaison hydrogène car la différence d'électronégativité entre l'atome H est les atomes S, Se ou Te, n'est pas assez importante.
Pas de liaison hydrogène, donc pas de paquets de molécules, donc, température de changement d'état plus basse...
ah d'accordd mais je ne comprends pas encore la 4 j'ai un fameaux pb !!!
est ce qu'il ya toujours des force de van der waals dans l'eau ?
Les forces de Van der Waals existent dans tous les composés, mais elles sont beaucoup plus faibles que les forces dues aux liaisons hydrogène.