Inscription / Connexion Nouveau Sujet
mesure du pH d'un gel javel
bonjour, en mesurant le pH d'un gel javel avec un papier pH classique, le papier a tout d'abord pris une couleur très claire (proche du jaune pH 5) puis s'est déteint vers le blanc.
voir par exemple cette image 
pourtant théoriquement le pH de l'eau de javel est basique. s'agit-il d'une erreur de mesure? comment peut-on l'expliquer
Edit Coll : image placée sur le serveur de l'  Merci d'en faire autant la prochaine fois !
Merci d'en faire autant la prochaine fois ! 
![]()
Salut  !
!
Il faut voir la compo de ton gel Javel.
Tu travailles sous quelle atmosphère ? Tu as abondamment arrosé le papier ? Il vient d'où ce papier ?
Oui je sais ça fait très inquisiteur mais ce n'est pas le but 
Désolée pur le double post, voici la figure que je cherchais :
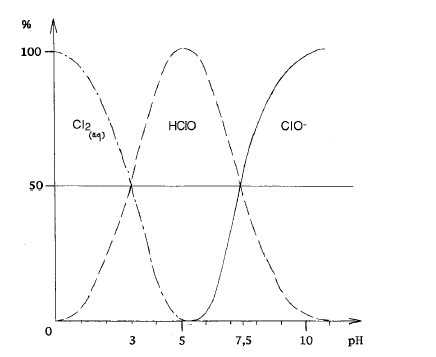
Tu peux facilement estimer la compo de ton eau de Javel avec ça.
Depuis combien de temps as-tu ce produit ? C'est une eau de Javel commerciale ?
c'est un gel gavel d'une enseigne de discount. le flacon est récent (acheté cette année).
le papier pH fonctionne bien pour tous les autres produits, à part l'eau de javel qu'il décolore.
je vais essayer de refaire l'expérience dans les jours qui viennent pour plus de détails.
Ce n'est pas si surprenant, on peut tout à fait avoir une eau de Javel avec un pH inférieur à 5. Je pense que ça dépend fortement du labo qui prépare le produit, ça peut tout aussi bien être un extrait d'eau de Javel qui dans ce cas se décompose plus rapidement qu'une simple eau de Javel diluée.
La compo de l'eau de Javel est fonction du pH. A la base, on a les équilibres suivants :
HClO + H+ + Cl- = Cl2 + H2O
HClO = H+ + ClO-
Avec le graphe que j'ai mis auparavant on peut clairement voir les espèces dominantes vers pH ~ 5-6.
Le problème quand tu as une eau de Javel acide c'est qu'elle est à mon sens encore plus dangereuse. Si tu as des substances acides qui entrent en contact avec lors de n'importe quelle manip', les risques de production de dichlore Cl2 sont élevés.
La stabilité de ton eau de Javel est bien sûr soumise aux lois de la cinétique chimique.
Par des calculs simples on peut facilement voir que la vitesse de décomposition est susceptible de doubler avec une augmentation de la température de 5°C. Donc selon l'endroit de stockage... De plus la réaction peut-être catalysées par des catalyseurs assez communs (ions métalliques, lumière surtout si les UV sont forts). C'est pour ça que ce type de produits est généralement conservé dans des récipients opaques non métalliques, et qu'il y a souvent du dichromate de sodium en solution.


