Inscription / Connexion Nouveau Sujet
etat ordonne
Bonjour,
quelle est l echelle des etats selon leur ordre,je deamde cela dans le cadre de l interpretation a l echelle microscopiques des aspects d un changemen t dd etat ou l on doit savoir si l etat final est plus ou moins ordonne que le precedent.
merci pour vos contributions
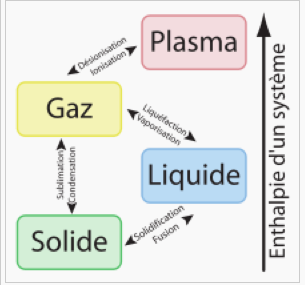
voir le diagramme ci-dessous pour avoir une échelle d'enthalpie correspondant aux différents états.
pour savoir si l'état est plus ou moins ordonné, on utilise l'entropie qui mesure le degré de désordre d'un système au niveau microscopique.
est-ce que vous pourriez préciser la question?
merci
a l echelle microscopique le changement d etat d un corps est le passage a un etat moins ordonne ou plus ordonne . s il y a passage meme si ce n est pas directement d un etat solide a un etat gazeux qu est ce qui nous permet de dire qu il y a rupture d interactions attractives a l echelle microscopique?
Normalement pour étudier le fait qu'un système soit plus ordonné ou pas on utilise une grandeur appelée entropie mais ce n'est pas du tout de ton programme.
Donc je vois pas trop comment t'expliquer en utilisant ce que vous voyez en Terminale. Surtout que c'est assez logique de dire que dans un solide les forces d'attractions sont beaucoup plus importantes que dans un liquide et encore plus que dans un gaz.
Salut,
Du point de vue microscopique, il est tout à fait spectaculaire que des milliards de molécules se mettent en rang comme à la parade à une température critique! +1°C, c'est le bazar, -1°C c'est le défilé du 14 juillet.
Landau explique ceci assez bien avec sa théorie du champ moyen. Il invoque pour cela un paramètre d'ordre, qui n'existe que dans la phase ordonnée.
Pour ce faire il utilise l'énergie libre où apparait une compétition entre deux termes : l'énergie et l'entropie.
Enfin, le plus intéressant est l'aspect universel de ces transitions. Il y a ainsi une parfaite analogie entre une transition eau-gaz et une transition ferromagnétique/paramagnétique.


