Inscription / Connexion Nouveau Sujet
Acido-Basique
Madame, monsieur,
Je suis actuellement étudiante en première année de licence Chimie-Biologie et Sciences de la Vie et de la Terre (CB/SVT) à l'UPEC (l'Université Paris-Est Créteil Val-de-Marne). J'ai besoin de votre aide puisque je n'arrive pas à faire l'exercice 1. Pourriez-vous m'aider ? Merci.
Exercice 1 :
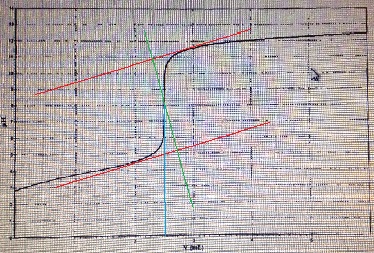
Le graphe ci-dessous représente le titrage pH-métrique de 50mL d'une solution d'acide ascorbique par une solution de soude (Na+, OH-) concentré à 0,4 mol/L.
1)Quelle est la concentration de la solution d'acide ascorbique utilisée dans ce dosage ?
2)D'après ce graphe, peut-on affirmer si l'acide ascorbique est un acide fort ou un acide faible ?
3)Quelle valeur de pKa de l'acide ascorbique peut-on déduire du graphe ?
4)En notant « AH » l'acide ascorbique et « A-» l'ion ascorbate :
a. Ecrire la reaction qui intervient lors de l'addition de soude.
b. Calculer la valeur de la constante correspondante.
5)Parmi les espèces H3O+, OH-, AH et A-, indiquez (aucune justification exigée) laquelle (lesquelles) est (sont) majoritaire(s) dans la solution titrée lorsque le volume de soude ajouté est égal à :
a.V = 0mL
b.V = 1,25mL
c.V = 2,5mL
d.V = 6mL
Ma reponse:
1)
2) le graphe commence de manière rectiligne donc c'est un Acide fort.
Véq= 25 mL et pH= 8
3) je sais qui faut utiliser la formule pH = pKa + log [base]/[acide] mais comme je n'ai pas trouver pour la question 1 donc je pourrai pas faire se calcule.
4) a.je pense que : AH => A- + H-
b.je sais qu' il faudra utiliser cette formule : Ka = [A-]*[H3O+]/[AH]
5)