Inscription / Connexion Nouveau Sujet
geometrie des molecules
bonjour, on a contrôle sur la géométrie des molécules, mais le problème c'est que je n'arrive pas à faire la différence entre l'arrangement et la géométrie, de plus je ne sais pas quand une molécule est:
- tétraédrique
- pyramidale à base triangulaire
- coudée
- plane
- linéaire
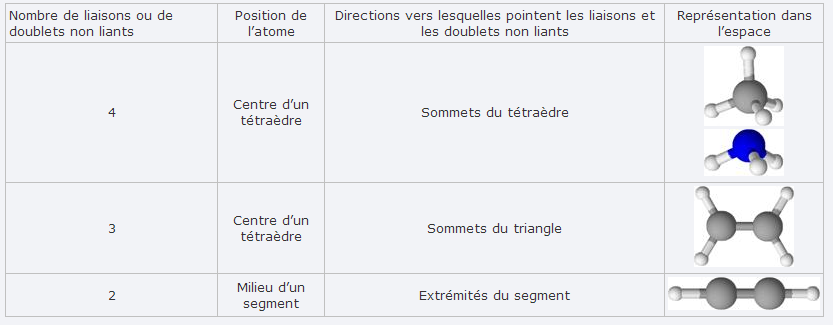
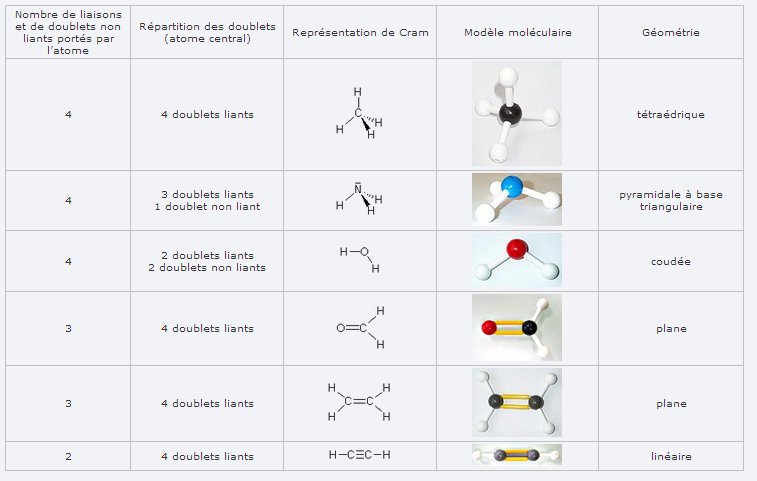
dans notre cours on a seulement ces 2 tableaux:
salut  !
!
Absolument tout t'est indiqué dans ces tableaux qui sont de très bonne facture ! Il te suffit de compter les doublets
En fait, les atomes de ta molécule ont une certaine charge (delta) due à l'électronégativité. Donc ils vont se repousser les uns les autres pour que la molécule soit la plus " à l'aise" possible. Imagine que tu accroches 4 amants (tous de la meme face : on va dire soit tous du coté + soit du coté -) (en vrai on dit face nord et face sud mais on s'en fou pour toi). Ces 4 amants tu les accroches a des fils (à peu près de la meme taille : qui représente les liaisons). Et tu les tiens l'extrémité du fil entre ton pouce et ton index en l'air. Les 4 amants vont se repousser un peu les uns les autres.
Ici c'est pareil, les atomes se repoussent comme les aimants.
Déjà comme tu peux le voir. Ca se passe seulement avec un seul atome au centre.
En gros tu as un atome au centre. Et autour tu as les atomes qui se positionnent pour "minimiser les répulsions".
Un carbone ne peut faire que 4 liaisons par exemple. Je ne sais pas si tu as vu ca en chimie organique par exemple. Avec les carbones asymétriques.
Le problème qui se pose ensuite c'est que tu peux avoir des doublets non liants à la place d'un atome. Cela signifie que pour savoir quelle géométrie la molécule va avoir tu considères que ce doublet c'est comme un atome mais qui repousse encore plus que les atomes. Il prend plus de place que les atomes. Mais en vrai ce doublet non liant tu le vois pas, alors que les atomes eux oui.
Donc si tu regardes ta molécule AVEC le doublet non liant tu dessines un tétraèdre (ou presque, car le doublet prend plus de place, donc les 3 autre atomes se retrouvent un peu plus proches entre eux).
Si tu regardes ta molécule ensuite comme tu la verrais en vrai (le doublet non liant étant invisible) tu enlèves la partie du doublet non liant sans modifier la géométrie de la molécule.
Et ca te donnera une pyramide à base triangulaire.
Souvent les atomes que tu vas considérer font toujours 4 liaisons (ces liaisons sont soit des doublets non liant[invisible], soit des liaisons qui mènent à un atome [visible]).
Après si tu as 2 doublets non liants ba tu vois les doublets non liants vont remplacer 2 liaisons sur les 4. Et les 2 doublets se positionnent souvent symétriquement, et donc ils se compensent car chacun pousse autant de chaque coté. Donc ta molécule est linéaire.
Etc ...
Les doublets non liants et les atomes les plus électronégatifs (ceux qui prennent le plus de place) sont dans le plan équatorial (je ne sais pas si tu as vu ou pas encore) car il y'a plus de place dans ce plan donc ils se repoussent moins (le but étant de minimiser les répulsions).
Dans un tétraèdre il n'y a pas de plan équatorial et vertical, car toutes les positions sont identiques. Si tu tournes ton tétraèdre tu retomberas toujours sur la meme géométrie, si tu inverses 2 atomes aussi. Ce n'est pas le cas des autres.
J'espère avoir pu t'aider un peu. Meme si ce n'est pas simple à expliquer par écrit. C'est plus simple dans la réalité avec des exemples avec des crayons.
Bon courage.
bonjour, j'ai encore un problème:
-dans la question d) que l'on a corrigé en classe, on a répondu:
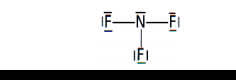
L'atome d'azote est impliqué dans trois liaisons simples : la trifluoroamine a donc une géométrie pyramidale à base triangulaire.
mais dans un autre exercice, dans la question b), on a répondu
-l'atome d'azote est impliqué uniquement dans des liaisons simples, ses doublets adoptent donc un arrangement tétraédrique.
ce qui contredit ce qui est marqué dans la tableau et de plus comment faire la différence entre une molécule qui est pyramidale et tétrédrique.
merci D'AVANCE