Inscription / Connexion Nouveau Sujet
Dm Electrozingage : dépot de zinc par électrolyse
Bonjours a tous ! voila j'ai quelques petits soucis avec cet exercice, merci d'avance pour vos réponses !
Voici l'énoncé :
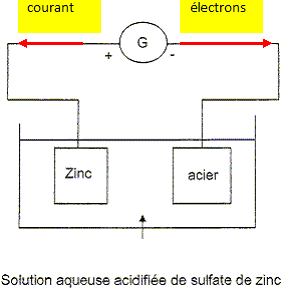
Le schéma du montage est donné. La pièce en acier est plongée dans une solution aqueuse de sulfate de zinc acidifié ( Zn2+ + SO42- ). Elle est reliée au pole négatif du générateur. La pièce en zinc est reliée à la borne positive du générateur.
1. Déterminer le sens du courant I et celui des électrons (fait sur le schéma )
2. On observe que la pièce de zinc se désagrège. Préciser la réaction ayant lieu au niveau de la pièce de zinc. Utiliser l'un des couples ci-dessous : Zn 2+ (aq) /Zn(s) ; O2(g)/ H2O (l) ; H+ (aq) / H2 (g)
Ma réponse : Zn (s)  Zn2+ + 2e-
Zn2+ + 2e-
3. Est-ce une réduction ou une oxydation? Justifier.
Ma réponse : C'est une oxydation car l'oxydant Zn2+ capte des électrons.
4. Ecrire la réaction qui a lieu au niveau de l'acier, réduction ou oxydation ?
La j'ai un problème, je pense que c'est une réduction mais je ne sais pas quelle(s) formule(s) je dois utiliser... Si quelqu'un peut m'expliquer ce serait très gentil 
5. Qui est la cathode, qui est l'anode ?
Ma réponse : d'après ce que j'ai trouvé sur internet : l'anode correspond à la borne plus donc ce serait le Zinc et la cathode la borne négative donc l'acier.
6. Le zinc a un potentiel électrochimique plus bas que l'acier, l'acier sera-t-il protégé en cas de microfissures ? Justifier.
Ma réponse : L'acier sera protégé car le zinc est plus réducteur que l'acier et par conséquent s'oxydera à sa place (c'est la protection cathodique ).
7. Quels sont les facteurs environnementaux de la corrosion ?
Ma réponse : La corrosion nécessite du dioxygène (de l'air ou dissous) en présence d'humidité. De plus la présence de sel dans l'eau accélère la corrosion (à cause des ions chlorure).
Voila encore merci par avance de votre aide ! 
Salut  !
!
Tout ce que tu as fait est ok.
Pour ce qui est de la question manquante (plutôt étonnante je dois l'avouer dans un exercice portant sur l'électrozingage). Oui c'est effectivement une réduction. Regarde les deux couples restants que l'on te donne plus haut
Bonsoir,
Dans l'ensemble, les réponses sont correctes. En ce qui concerne les justifications de la 3, je mettrais plutôt que Zn (réducteur) est oxydé en Zn²⁺ (oxydant).
Pour la question 4, tu as tout à fait raison. À l'autre électrode, siège une réduction. Penses à la présence des ions H⁺ dans toute solution.
Petit conseil pour la détermination des éléctrodes : pense aux relations oxydation/anode et réduction/cathode. Cela pourra t'éviter des confusions entre borne positive du générateur et électrode positive.