Inscription / Connexion Nouveau Sujet
Chimie. pKa et réactions d'affinités
Bonjour, je voulais juste savoir si mon raisonnement était juste. Pouvez vous m'indiquer mes éventuelles erreurs?
Une solution aqueuse est constitué d'hydroxyde de sodium OH- et d'ions amonium NH4+.
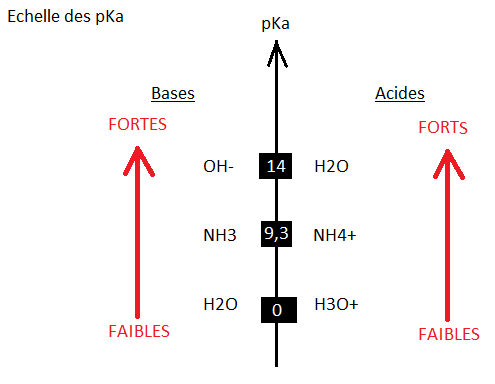
je donne: pKa(NH4+/NH3)= 9.3 pKa(H2O/OH-)= 14 pKa(H3O+/H2O)=0
Le but est de savoir quelles sont les réactions qui se produisent en fonction des pKa.
Plus le pKa d'un couple est élevé, plus l'acide et la base sont forts.
Si on regarde le tableau que j'ai fais (s'il est juste), on constate qu'une base forte (ici OH-) ne peu que réagir avec un acide fort (le plus fort dans la solution = HH4+).
Ici le couple H3O+/H2O ne réagit avec "personne".
L'équation de la réaction est : OH- + NH4+ = NH3 + H2O
Si on retirait le couple (NH4+/NH3) alors la base OH- réagirait avec l'acide H3O+
L'équation de la réaction serait donc: OH- + H3O+ = H2O

 !
!


