Inscription / Connexion Nouveau Sujet
Pile de concentration, où est anode et cathode?
Bonsoir, ce qui va suivre est un énoncé plus mon raisonnement à la question posée.
Quelque chose ne colle pas dans mon raisonnement mais je ne saurais dire quoi…
Je sais que ça fais pas mal de lecture mais c'est très important que je comprenne mon erreur.
Je compte sur vous !
voici mon énoncé :
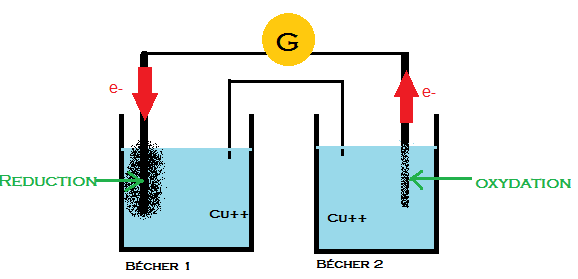
Une pile de concentration est réalisée avec deux demi-piles au cuivre. Deux lames de cuivre de potentiel E1 et E2 plongent dans deux béchers 1 et 2.
Le bécher 1 contient une solution 1 de sulfate de cuivre II de concentration C1 = 1 mol.L-1.
Le bécher 2 contient une solution 2 de sulfate de cuivre II de concentration C2 = 0.4 mol.L-1.
On observe une différence de potentiel : E1 - E2 = 100 mV
L'équation bilan de fonctionnement de la pile est Cu + Cu++ => Cu++ + Cu
Question : dans quel bécher se trouve l'électrode positive ?
Ma réponse : Nous constatons que les concentrations en ions cuivre II sont différentes d'un bécher à l'autre.
Le bécher 1 possède une concentration plus élevé que bécher 2. Il va donc devoir perdre un peu de sa concentration pour arriver à un équilibre avec bécher 2.
Pour cela les ions cuivre II de bécher 1 vont puiser les électrons de l'autre solution afin de former sur électrode 1 du cuivre solide (réduction des ions fer II) . Cela va entrainer une diminution de la concentration en ions cuivre II.
Dans bécher 2 c'est exactement l'inverse. La concentration en ions Cu++ est trop faible par rapport à bécher 1. La concentration va donc gagner des ions Cu++ en envoyant dans son électrode2 des électrons. Ceci aura donc pour incidence une « dilution » d'une partie de l'électrode2 (oxydation du cuivre solide).
Les électrons circulent donc du bécher 2 au bécher 1. Le courant circule lui toujours dans le sens inverse des électrons donc du bécher 1 au bécher 2.
Ce qui fait que électrode 1 est la borne négative (on rappel bien que nous sommes dans une pile et non une électrolyse) donc ici l'anode et à l'inverse electrode2 est positive et cathode.
On sait qu'à la cathode se passe toujours des réductions et à l'anode des oxydations.
Or ici dans ma pile de concentration je viens de démontrer le contraire.
Je sais que j'ai du me tromper quelque par dans mon raisonnement mais où je ne serais pas dire.
Pouvez-vous m'aider ? Merci
presque tout est juste sauf
Ce qui fait que électrode 1 est la borne négative (on rappel bien que nous sommes dans une pile et non une électrolyse) donc ici l'anode et à l'inverse electrode2 est positive et cathode.
l'anode est l'électrode 2 Elle repousse dans le circuit extérieur les électrons libérés par loxydation du métal Cu.Donc éléctrode négative.
la cathode est l'électrode 1 Elle attire les électrons du circuit extérieur .Ces électrons permettent le réduction de Cu2+.
Donc électrode positive.
les électrons circulent du - vers le + sens inverse du sens conventionnel.(+ vers -)
je ne vois pas où est la contradiction
je vais vous montrer mon raisonnement:
Schéma1
sens de circulation des électrons
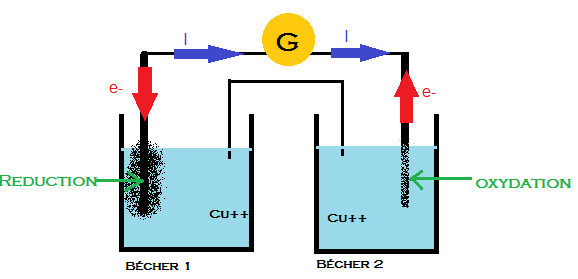
Schéma2
On sait que le sens des électron est toujours inverse de celui du courant donc on détermine le sens du courant
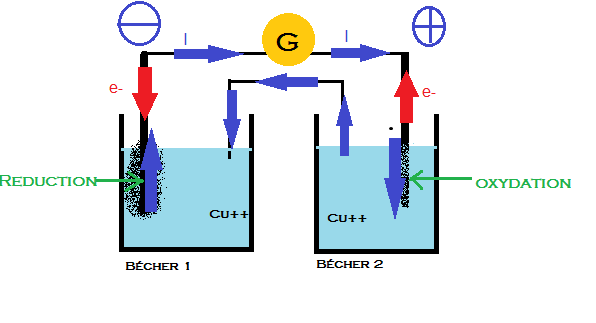
Schéma3
On sait que le courant circule de la borne + à la borne - donc on en déduit les polarités (en bleu)
Je sais que j'ai faux mais je n'arrive pas a voir ou est mon erreur...
que vient faire le générateur (jaune dans le dessin ) Il faut mettre une résistance ,par exemple (récepteur)
Le générateur ,c'est la pile.
le moins ,est à l'anode (électrode 2)
le + est à la cathode (électrode 1)
il faut donc inverser les pôles du 3ème schéma et remplacer G par R (résistance)
Autre question:
On nous dis que cette pile transforme entièrement son énergie chimique en énergie électrique . Cela veut donc dire qu'il n'y a ni perte ni résistance et que le rendement est de 100% ?
L'énergie chimique n'est pas intégralement transformée en énergie électrique.
Une partie est perdue sous forme de chaleur.
le rendement est donc inférieur à 100%


