Inscription / Connexion Nouveau Sujet
Usure d'une pile
Bonjour, j'aimerais avoir de l'aide pour cet exercice :
La réaction se produisant dans une pile a pour équation : Cu2+(aq)+Pb(s) Cu(s)+Pb2+(aq).
Cu(s)+Pb2+(aq).
a) Quels sont les couples redox mis en jeu ?
b) Quelle est la borne positive de cette pile ?
c) Pour chacune des demi-piles, on utilise un volume V=50ml d'une solution dont la concentration initiale en cation métallique vaut C=0,5mol.l. L'électrode de cuivre a une masse m=4,2g et celle de plomb=9,7g.Déterminez l'avancement maximal de la réaction. Lorsque l'avancement maximal est atteint, cette pile peut elle xontinuer de fonctionner ?
j'ai fait:
a) Cu2+/Cu et Pb2+/Pb
b) c'est la cathode où se produit l'oxydation
c) ncuivre=0,07 et nplomb=0,05 après je ne sais pas
merci
Bonsoir,
reprenons pas à pas les questions :
a) Ok ! Pas de soucis, tu maîtrises ton cours sur les réactions d'oxyréductions. Peut-être pourrais-tu écrire à côté les demi-équations correspondantes, elles te serviront plus tard.
b) Je t'arrête tout de suite. A la cathode se produit toujours une réduction. Un petit moyen mnémotechnique pour s'en souvenir : "Cathode" et "Réduction" commencent par une consonne et "Anode" et "Oxydation" par une voyelle.
Pour déterminer la borne positive, réfléchis au sens du courant et donc au sens des électrons. Le courant circule de la borne positive à la borne négative. Or le parcours des électrons est inverse : ils vont donc de la borne négative vers la borne positive. A la borne positive, il y a donc apport d'électrons, ce qui correspond à un gain d'électrons. A quel type de demi-équation cela correspond-t-il ? En déduire quelle électrode est la borne positive.
c) Détermine les quantités de matière à l'état initial, c'est-à-dire n(Cu2+), n(Pb2+), n(Cu), n(Pb). Dresse le tableau d'évolution du système correspondant. Déduis-en xmax puis l'état final. Enfin répond à la question posée.
a) ok
b) cela correspond à une réduction avec un oxydant du type Ox+e-=red
c) n(Cu)=4,2/63.5 et n(Pb)=9,7/207,2 mais comment faire pour les ions ? et comment utiliser C et V ?
b) Lorsqu'on te demande de quelle borne il s'agit, on attend que tu indiques s'il s'agit de l'électrode en cuivre ou en plomb. Tu approches de la réponse.
c) Tu sais que la concentration en ions métalliques est C = 0,5 mol.L-1 et que le volume de solution dans chaque demi-pile est V = 50 mL. Ne peux-tu pas trouver n(Cu2+) et n(Pb2+) avec la relation entre concentration molaire, volume et quantité de matière.
b) réduction donc borne positive donc électrode de ? je ne sais pas les deux sont positifs
c) si donc n(Cu2+)=n(Pb2+)=0.025mol
Pour la question b) je vais te guider :
1) Ecrire les deux demi-équations.
2) La borne positive correspond-t-elle à un apport ou une libération d'électrons ?
3) En déduire le type de réaction ayant lieu à la borne positive ?
4) Sélectionner la demi-équation en question et dire de quel électrode il s'agit.
Pour la question c), maintenant que tu as les quantités de matière à l'état initial, dresse comme d'habitude ton tableau de variation. Conclure.
Cu2++2e-=Cu
Pb2++2e-=Pb
borne positive=cathode=réduction=captage d'électrons donc apport mais mes deux demi éqations ont la meme forme...?
Ah oui mais dans quel sens ont-elles lieu ? Là est toute la question. Par de l'équation de la pile en général : Cu2+(aq)+Pb(s)Cu(s)+Pb2+(aq), elle correspond à la "somme" des deux demi-équations. Tu peux donc en déduire dans quel sens se produit chacune d'entre elles.
en effet donc Cu2++2e-=Cu et Pb=Pb2++2e- mais dans le cas général, comment je fais pour distinguer l'oxydant d'un réducteur (ex avec C2H4O2/C2H5OH?)
donc ici borne positive=cathode=réduction=Pb
Je crois avoir compris ton problème : comment reconnaît-on un réducteur, une réduction, un oxydant, une oxydation.
Dans un couple Red-Ox, l'oxydant est toujours à gauche : Ox/Red donc C2H4O2 (ox)/ C2H5OH (red)
Maintenant si tu te trouves face à une demi-équation, pars toujours d'un principe simple :
"les électrons sont toujours du côté de l'oxydant" Avec ça tu peux trouver tout le reste.
Ainsi, une réduction forme un réducteur (il n'y a donc pas d'électrons à droite) et une oxydation un oxydant (avec électrons à droite).
Quelques exemples
- Cu2+/Cu : quel est l'oxydant ? le réducteur ?
- MnO42- + 8 H+ + 4e- = Mn2+ + 4 H20
S'agit-il d'une oxydation ou d'une réduction ? Ecrire le couple Red-Ox.
Maintenant reprend la détermination de la borne positive et corrige ton erreur !
ok merci donc : Cu2+ est l'oxydant et aussi MnO42- aussi
donc ici en b) borne positive=cathode=réduction=oxydant
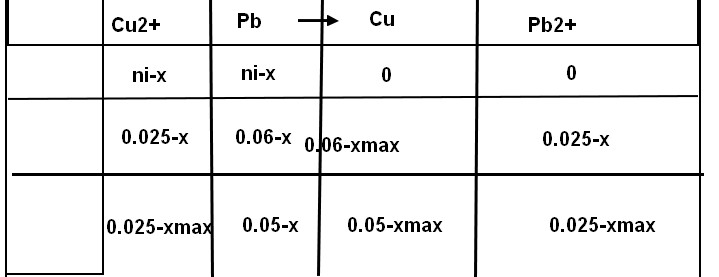
Ton tableau est faux ! n(Cu) = 0 ??? n(Pb2+) = 0 ??? c'est pas ce que tu as écrit avant ... ! Ta première ligne du tableau est fausse...
Cela n'empêche pas qu'il y a déjà des produits dans le milieu. Quand tu brûles quelque chose dans l'air : tu consommes du O2 et produit du CO2 or il y a déjà du CO2 dans l'atmosphère, nan ?
oui...je suis un peu perdue là pouvez vous me détailler votre tableau ? et sinon ma réponse à la b) est dans le message de 20h53
Ta réponse à la b) est incomplète car tu ne réponds pas à la question qui te demande à quelle électrode correspond la borne positive.
Je vais te faire le tableau, patiente un peu.
NB : le tutoiement ne me dérange pas !
Les deux demi-équations ayant lieu aux électrodes sont :
Cu2+ + 2e- = Cu (1) : à l'électrode de cuivre
Pb = Pb2+ + 2e- (2) : à l'électrode de plomb
En sommant les deux demi-équations, on retrouve bien l'équation globale de la pile.
(1) est un réduction (formation d'un réducteur), elle a donc lieu à la cathode où il y a apport d'électrons. Il s'agit donc de l'électrode de cuivre qui est la borne positive.