Inscription / Connexion Nouveau Sujet
Polarité d'une molécule et interactions.
Bonjour, quelqu'un pourrait-t-il m'expliquer pourquoi le trifluore de bore est-il apolaire sans les barycentres(on verra ça l'an prochain) j'ai essayé avec la somme géométrique des moments dipolaires mais je n'y arrive pas.
Bonsoir,
Si on considère seulement DEUX des trois "branches" de la molécule, et qu'on réalise leur somme vectorielle, on obtient le vecteur rouge. Or il se trouve que ce vecteur rouge a exactement la même direction que le vecteur restant, et il a aussi la même norme, par contre, son sens est opposé. Ainsi, la somme de ces deux vecteurs est nulle et le moment dipolaire du trifluorure de bore est nul, donc cette molécule est apolaire.
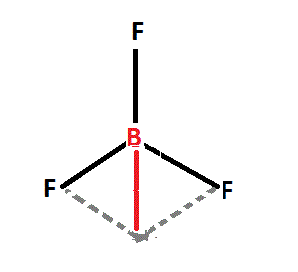
Bonjour,
une molécule est polaire ou apolaire, il faut tout d'abord connaître la géométrie de la molécule comme c'est trétraédrique on en déduit que le trifluore de bore est apolaire.



