Inscription / Connexion Nouveau Sujet
polaire ou non ?
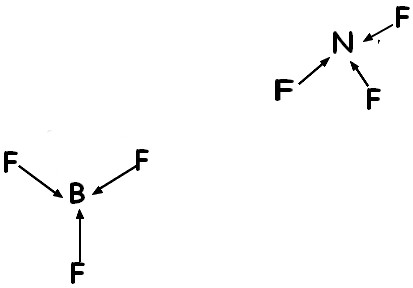
Bonjour j'ai fait un exercice qui me demandait de prouver que le trifluor de bore était apolaire et le trifulore d'azote était polaire. J'ai compris pour le premier mais impossible de démontrer que le deuxième est polaire car ils ont la même constitution non ? Comment savoir ou bien placer les molécules pour ne pas se tromper ?
Sur ma première image on voit bien que la molécule est apolaire mais au début, j'avais placé les deux fluor de façon linéaire et le dernier sous le bore et j'avais alors trouvé que la molécule était polaire...pouvez vous m'expliquer comment savoir placer les molécules pour ne pas se tromper ?
merci
Bonsoir,
Pour savoir si une molécule est polaire ou apolaire, il faut tout d'abord connaître la géométrie de la molécule
oui justement mais dans cet exercice, on ne la donnait pas...et c'est justement dans ce cas là que j'aimerais avoir une méthode
IL est déjà sur internet, et je pense qu'il cherche un interlocuteur pour comprendre, et poser ses questons au cas ou au lieu de lire une page, de comprendre sur les cas explicité, et pas savoir refaire.
Pour trouver la géométrie, il y a plusieurs étapes a respecter car la géométrie va dépendre du nombre de liaison de l'atome central (et de ses doublets non liants qui jouent ici le même rôle qu'une liaison covalente)
1) Représenter la molécule selon Lewis pour repérer les liaisons et doublets libres autour de l'atome centrale.
2) Se dire que les liaisons (et doublets libres) se répartissent (grossomodo) de façon a être le plus "loin" l'un de l'autre (une liaison covalentes ou un doublet libre, c'est des électrons => charge de même signe (négatif) => se repoussent)
Donc on compte les doublets libres et les liaisons autour de l'atome central, on additionne ces 2 chiffres (liaisons et doublets libres jouent le même rôle) et on sait que
2-> linéaire
3-> triangulaire (cas du trifluor de Bore je suppose)
4-> ??? ( )
)
5-> pyramide a base triangulaire
...etc...
3)Molécule parfaitement symétrique est apolaire ("symétrique" au niveau des liaisons et des atomes au bout de la liaison : H2O n'est pas "symétrique", CO2 est "symétrique", CH3Cl n'est pas "symétrique",...)
Sinon, elle est polaire.
Voilà
Ça va mieux ?
Merci 
Le but, c'est de comprendre la base.
Après, ça, c'est le début de l'histoire, le "il était une fois...", ya tellement de trucs a dire sur ces petits trucs!!!^^
* juste : H2O est polaire car sa structure est coudée mais pourtant on compte 4 liaisons en tout (avec doublets non liant ? )
Oui, il a 2 liaisons covalente O-H, et 2 doublets liants, ça fait bien 4.
Mais elle a quelle forme la molécule d'eau ? (pour t'aider au début, pour toi, tu peux représenter les doublets non-liants comme des liaisons...avec rien au bout)
Tout vient de la géométrie.
Oui, bien sûr,...mais c'est sympa aussi de comprendre, même si c'est "marqué dans l'énoncé", non ? 
Si tu répond a ta pertinente question sur la molécule d'eau, tu comprendra pourquoi on la représente souvent coudée, alors que le plus simple et le plus intuitif aurait été de faire ça en linéaire avec un doublet de chaque côté du O :
_
H-O-H
-
Si elle avait la géométrie que je t'ai mis (linéaire) elle serait apolaire (t'as bien compris a ce que je vois  )
)
...Mais elle est polaire...pourquoi  ? (une géométrie a 4 "branches", c'est linéaire?)
? (une géométrie a 4 "branches", c'est linéaire?)
(Sans la polarité de l'eau, on aurait beaucoup plus de mal a dissoudre des trucs dedans!!! (tout se tient dans la chimie  )
)
ok  mais je ne peux pas le deviner si on ne le précise pas non ? car oui à 4 branches normalement c'est linéaire ou tétraédrique
mais je ne peux pas le deviner si on ne le précise pas non ? car oui à 4 branches normalement c'est linéaire ou tétraédrique
4 branches c'est linéaire ??
Tu va te faire décapiter si tu dis ça a un chimiste...
Sérieusement : Linéaire => tu peux tracer une droite passant par tous les atomes du composé...bonne chance avec 4 branches...
Non, c’est bien tétraèdrique, et de toutes les manière que tu positionne les 2 Oxygène au bout des liaison, tu vois un angle entre les O, d'où me fait que cette molécule est préférentiellement représentée coudé plutôt que linéaire : le coudé se rapproche plus de la géométrie réelle, même si la représentation de Lewis linéaire n'est pas fausse...mais représente mal la réalité ;
Regarde, un tétraèdre, ça a cette forme la, et c’est la plus stable (là ou les électrons sont le plus loin les un des autres, le plus peinard possible)
***
édit Océane
ok je vais regarder ça mais H2O c'est plus les deux H au bout des liaisons non ? ^^en plus j'ai remarqué que les molécules linéaires avaient souvent un atome Carbone
...oui, en effet un H2O avec 2 O, c'est pas un H2O...excuse moi, honte à moi...
Pour le coup du carbone en linéaire, je ne généraliserais pas...c'est parce qu'on rencontre beaucoup le carbone que tu a due remarquer ça, mais il y beaucoup de cas possibles avec autre chose que le carbone
Bonjour,
IL est déjà sur internet, et je pense qu'il cherche un interlocuteur pour comprendre, et poser ses questons au cas ou au lieu de lire une page, de comprendre sur les cas explicité, et pas savoir refaire.
J'ai l'impression que certaines personnes ne lisent pas tous mes posts
 :
:
Ou alors elle fait partie de ton cours et tu dois donc savoir sa géométrie
Si, j'ai bien lu ton post en entier, mais il faut se dire que les personnes qui viennent poser des questions sur ce forum ont déjà réfléchis a la question, retourné leur cours, demandé à google,...enfin fait ce qu'ils pouvaient tout seul...(ou doivent se sentir dans l'obligation personnelle de le faire avant tout)
Le principe même de la chose est de poser des questions a ceux qui savent pour pouvoir échanger, et avoir une réponse correspondant le plus précisément possible à la question posée, afin de ne pas s'embrouiller...
Internet, il fait pas ça, il te sors des biblos, qui, sans les bases, t'embrouillent plus qu'autre chose...
Ici la proposition d'aller sur internet était mal venue, selon moi, du fait que la question posée touche aux bases de la chimie, et les bases doivent êtres très solides...ce que ne te donne pas internet...
La question aurait été : "C'est quoi le pKa de CH3COOH?" oui, bon la, c'est sur qu'internet conviendra parfaitement...
Et je trouve pas sympa d'envoyer qqn qui vient ici avec une question précise et pertinente et qui semble s'intéresser a la chose, sur internet au lieu d'avoir la bonté de lui répondre qqch de précis...
D'après moi, ceux qui savent ont le devoir de faire passer le message a ceux qui ne demande qu'a savoir...au lieu de les renvoyer sur internet...(je ne sais pour quelle raison)



